Эволюция основных групп плацентарных
Плацентарные отделились от трехбугорчатых, по-видимому, тоже в начале мела. Наиболее примитивные формы их, относящиеся к отряду насекомоядных, открыты в верхних меловых отложениях.
По-видимому, они или близкие к ним формы дали начало всем прочим отрядам плацентарных, которые уже вполне сложились в течение первой половины третичного времени: вероятно, от древних насекомоядных непосредственно произошли не только современные насекомоядные, но и шерстокрылы, летучие мыши, полуобезьяны, обезьяны, а также древние хищные, объединяемые в группу креодонтов (Creodontia). Креодонты были мелкой или средней величины звери с короткими пятипалыми конечностями, стоявшие еще очень близко к насекомоядным, от которых они отличались режущими краями зубов. Креодонты, по всем данным, являются исходной группой для современных хищных и ластоногих. С другой стороны, к креодонтам близки: 1) древние непарнопалые (Mesaxonia), давшие несколько ископаемых групп и современных непарнокопытных; 2) древние парнопалые (Paraxonia — исходная группа для современных парнокопытных); 3) большая бесследно вымершая труппа южноамериканских копытных (Notungulata); 4) группа подкопытных (Subungulata), от которых, по-видимому, произошли современные даманы, хоботные и сирены. Что касается неполнозубых, трубкозубых и грызунов, а также, вероятно, китообразных, то эти древние группы, по всей вероятности, отделились непосредственно от древнейших. насекомоядных.
В середине третичного времени стали образовываться обширные степи, и целый ряд первобытных копытных начали приспособляться к жизни на открытых пространствах. Приспособления эти выражались в приобретении стройного, легкого телосложения, крепких конечностей с твердыми копытами, обеспечивающих быстрый и продолжительный бег, широких плоских жевательных поверхностей коренных зубов, способных перетирать твердую степную растительную пищу. Таким образом возникли, с одной стороны, лошади, с другой — многочисленные антилопы. В это же время, в связи с появлением разнообразной травянистой растительности, появились многочисленные мышевидные грызуны, в том числе полевки, песчанки, мыши, тушканчики и др. Разнообразие растительноядных форм вызвало обособление хищных, разбившихся на различные группы.
В конце третичного и начале четвертичного периода климат северного полушария претерпевал значительные изменения в сторону похолодания и усиления континентальности, связанные, видимо, с соотносительным перераспределением воды и суши. В это время где-то, по всей вероятности, в Юго-Восточной Азии, произошел от обезьяноподобного предка человек, и век крупных млекопитающих, господствовавших в течение третичного времени, сменился веком человека. Конечно, человек занял свое исключительное положение в природе не сразу. В это же время, т. е. в конце третичного времени, фауна северного типа, так называемая «мамонтовая фауна», включающая, кроме мамонта, еще зубров, шерстистых носорогов, северных оленей, леммингов и другие виды, спускалась дальше к югу, оттесняя так называемую «гиппарионовую фауну», включающую примитивных лошадей — гиппарионов, жирафов, верблюдов, страусов и других животных южного типа.
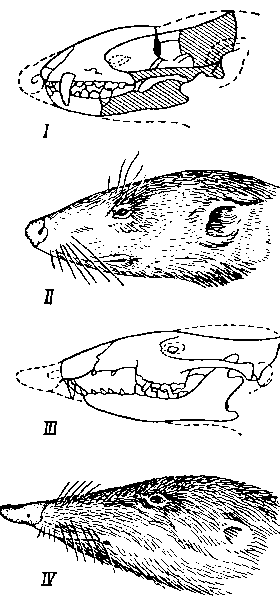
Меловые насекомоядные (по Грегори). I— череп Deltatherium pretrituberculate; II — реставрация Deltatherium; III — череп Zalembdalestes leschei; IV — реставрация
Как мамонтовая, так и гиппарионовая фауны, имели в своем составе много современных родов и даже видов. В дальнейшем из этих фаун сформировались современные фаунистические комплексы, при этом даже в среднечетвертичное время человек оказывал значительное влияние на фауну, или сокращая численность ряда крупных животных, или истребляя их, или способствуя их расселению.
Палеонтологические ряды некоторых млекопитающих. Эволюционные ряды некоторых млекопитающих удалось восстановить особенно подробно.
Еще интересные статьи по теме:
Алексей Лопатин, Александр Аверьянов
«Природа» №4, 2018
Об авторах
|
Алексей Владимирович Лопатин — академик РАН, доктор биологических наук, директор Палеонтологического института им. А. А. Борисяка РАН, профессор кафедры палеонтологии геологического факультета Московского государственного университета им. М. В. Ломоносова. Область научных интересов — морфология, филогения и эволюция позвоночных животных, биостратиграфия, палеобиогеография, палеоэкология, антропогенез. |
|
Александр Олегович Аверьянов — профессор РАН, доктор биологических наук, заведующий лабораторией териологии Зоологического института РАН, профессор Института наук о Земле Санкт-Петербургского государственного университета. Научные интересы связаны с морфологией и эволюцией позвоночных животных. |
Большинство современных млекопитающих (включая человека) плацентарные. Если уподобить эволюционное древо плацентарных обычному дереву, то можно выделить на нем крону (в современной филогенетической систематике кроновую группу) и ствол с опавшими ветками (стволовую группу). К кроновой группе Placentalia относятся как все современные плацентарные и их ближайший общий предок, так и все вымершие потомки этого предка. Остальная, полностью вымершая, часть древа — стволовые эутерии. Это таксоны, которые филогенетически ближе к современным плацентарным, чем к современным сумчатым. Кроновая и стволовая группы вместе называются общей, или тотальной, кладой Pan-Placentalia (= Eutheria). Сумчатые млекопитающие (Metatheria) — это сестринская клада для Eutheria. Обе они объединяются в кладу териевых и вместе со своим гипотетическим общим предком формируют кроновую группу зверей (Theria). В свою очередь, стволовыми териями именуются вымершие таксоны, филогенетически более близкие к общему предку современных териевых, чем к другим млекопитающим, например однопроходным, или яйцекладущим (Monotremata). Клады и группы филогенетической систематики отличаются от традиционных таксонов высокого ранга (классов, подклассов, отрядов, семейств и так далее) тем, что все виды или роды в конкретной группе имеют общего предка, который обязательно включается в такую группу.
Теперь, когда мы договорились о том, кого считать «своими», отметим следующие неожиданные факты. Если вымершие млекопитающие считаются эутериями в систематическом смысле, то это вовсе не означает, что они обязательно имели плаценту. А если метатериями, то не обязательно имели сумку. Первично все млекопитающие были яйцекладущими, как современные утконос и ехидна, и в основании эволюционных ветвей как плацентарных, так и сумчатых тоже находились яйцекладущие звери.
По данным молекулярной биологии предполагается, что дивергенция сумчатых и плацентарных млекопитающих могла произойти 147 млн лет назад [1]. Примерно тем же временем, т.е. раннемеловой эпохой, датируется появление в геологической летописи первых стволовых эутериевых млекопитающих. Тогда сушей безраздельно владели рептилии — многочисленные динозавры и их родственники. Для представителей древних групп млекопитающих (триконодонтов, симметродонтов, мультитуберкулят и др.) оставалась возможность развиваться лишь в мелком размерном классе, что они и делали уже многие миллионы лет. Древние плацентарные довольно быстро заняли важное место в сообществах. Но почему и как это произошло? Чтобы ответить на эти вопросы, нужно проанализировать некоторые аспекты строения скелета, репродуктивной биологии и образа жизни этих вымерших существ.
Пересчитать все зубы
Прежде всего отметим, что большинство находок мезозойских млекопитающих составляют фрагменты челюстей или даже изолированные зубы. Находки целых черепов и скелетов исключительно редки. Поэтому выводы об образе жизни этих древних форм носят преимущественно гипотетический характер. Удивительным образом способ размножения сумчатых млекопитающих нашел отражение в их зубной системе. Дело в том, что новорожденные детеныши сумчатых проводят один-два месяца в сумке матери, прикрепившись к ее соску. Из-за этого у них нарушается нормальная для стволовых териев смена зубов, в результате чего трансформируется зубная формула: у сумчатых в каждой половине челюсти всего три премоляра (предкоренных зуба) и четыре моляра (коренных), первый из которых, на самом-то деле, — несменяемый предкоренной зуб. Соответственно, если мезозойское млекопитающее обладало такой зубной формулой, его определенно следует относить к сумчатым. Также у древних сумчатых было больше резцов (пять верхних и четыре нижних), чем у ранних плацентарных (обычно четыре верхних и три нижних, хотя есть исключения).
Способ размножения плацентарных млекопитающих никак не отразился на их зубной системе. Они унаследовали от стволовых териев зубную формулу с пятью премолярами (сократившимися до четырех лишь у более поздних форм) и тремя молярами. Это создает определенные трудности при идентификации древнейших стволовых плацентарных.
Яркий пример таких трудностей — история с юрамайей (Juramaia sinensis), чей почти полный скелет был обнаружен в китайской провинции Ляонин в верхнеюрских (оксфордских) отложениях возрастом около 160 млн лет [2]. Это был мелкий зверек с длиной тела 7–10 см (без учета длины хвоста) и массой около 15 г. По характеру локомоции он напоминал современных крыс [3], а судя по строению зубов, питался насекомыми. При первоописании в 2011 г. этот род был отнесен к стволовым плацентарным млекопитающим, что вызвало сенсацию. Действительно, остатки эутериев еще никогда не находили в юрских отложениях.
Однако строение зубов юрамайи соответствует не эутериям, а примитивным стволовым териям — т.е. группе зверей, существовавших до расхождения ветвей сумчатых и плацентарных [4]. Несколько форм млекопитающих из раннего мела Северной Америки, обычно относимых к Eutheria [5, 6], — монтаналестес (Montanalestes keeblerorum), голоклеменсия (Holoclemensia texana) и паппотерий (Pappotherium pattersoni) — также должны рассматриваться среди стволовых териев [4].
Есть еще два кандидата на статус древнейших эутериев. Это дурлстотерий (Durlstotherium newmani) и дурлстодон (Durlstodon ensomi), описанные в 2017 г. из нижнемеловых (берриасских) отложений возрастом около 145 млн лет с побережья залива Дурлстон в Южной Англии [7]. Они плохо охарактеризованы: каждый вид представлен всего одним зубом, причем в обоих случаях это последний верхний моляр, диагностическое значение которого нельзя переоценивать. Однако и они демонстрируют по меньшей мере один очень продвинутый признак, неожиданный для столь древних эутериев, — дополнительные бугорки (конули) между внутренним бугорком (протоконом) и наружными (параконом и метаконом) у них приближены к последним. Этой особенностью оба английских вида напоминают так называемых желестид (Zhelestidae) из верхнего мела Центральной Азии. Безусловно, нужны новые находки дурлстотерия и дурлстодона, чтобы точнее понять их положение на филогенетическом древе Eutheria.
Находки несомненных древних эутериев отстоят от начала мелового периода на 15–35 млн лет. Наиболее полные происходят из китайской провинции Ляонин (там, напомним, была найдена юрамайя). Эомайя (Eomaia scansoria) из барремских отложений (возраст 125,5–130 млн лет) известна по целому скелету с отпечатком контуров тела и шерсти [8]. Судя по строению костей конечностей, эомайя вела древесный образ жизни и умела хорошо прыгать. Длина ее тела была около 10 см, а вес составлял 20–25 г. В отличие от более поздних плацентарных, животное имело по пять верхних резцов в каждой половине челюсти и по четыре нижних. Иногда считается, что строение костей таза эомайи (а именно наличие сумчатых костей) определенно свидетельствует, что эти животные не могли рожать крупных детенышей, а значит, физиологически не были плацентарными. Однако сумчатые кости связаны с кожной мускулатурой и поэтому никак не характеризуют размер детородного канала. Судя по зубной формуле (пять премоляров и три моляра в каждой половине челюсти), эомайя не была сумчатым. Это может означать, что эти млекопитающие либо имели плаценту, либо откладывали яйца, подобно однопроходным.
У плацентарных все три гена вителлогенина (белка-предшественника, служащего для построения желтка в ооците) — это псевдогены, утратившие кодирующую способность; у однопроходных работает один из этих генов. По генетическим оценкам [9], инактивация последнего из трех генов у сумчатых произошла не ранее 70 млн лет назад (т.е. в конце мелового периода), а у плацентарных — более 100 млн лет назад (т.е. в его середине). Такая инактивация должна соответствовать рубежу, когда предки этих групп перестали производить желток и откладывать яйца.
Акристатерий (Acristatherium yanensis) найден в отложениях нижнего апта (122,5–125,5 млн лет назад). Известен всего один череп довольно хорошей сохранности [10]. У акристатерия было по четыре верхних резца в каждой половине челюсти и по три нижних. На нижних коренных зубах акристатерия отмечен маленький дополнительный бугорок, служивший для усиления межзубного сцепления в нижнем зубном ряду. Почему-то этот бугорок исчез у других эутериев, исключая ховурлеста, о котором рассказывается ниже.
В России, в Бурятии, был обнаружен муртойлест (Murtoilestes abramovi), чьи остатки представлены тремя изолированными коренными зубами из пограничных отложений баррема и апта (около 122,5 млн лет назад) [11].
Cасаямамил (Sasayamamylos kawaii) был найден в 2007 г. в Японии, в префектуре Хёго, в серии Сасаяма раннеальбского возраста (около 112 млн лет назад) [12]. Описано несколько довольно полных нижнечелюстных фрагментов, по величине которых реконструируется длина тела в 10–15 см. Передняя часть нижней челюсти сасаямамила необычным образом вздернута вверх, из-за чего резцы поставлены почти вертикально, а клык и вовсе загибается назад. На рентгенографии видно, что задний наклон клыков всех экземпляров существенно усилен из-за фрагментации корневой части, но и его вертикальная постановка (в меньшей степени выраженная также у эомайи) свидетельствует о какой-то особой пищевой специализации — возможно, о питании сравнительно крупными насекомыми, например жуками.
И числом, и умением
Уникальный источник сведений о раннемеловых млекопитающих представляет собой местонахождение Ховур, расположенное на севере пустыни Гоби в Монголии. Возраст местонахождения определяется в пределах аптского — альбского веков раннего мела (110–120 млн лет назад). Здесь найдены многие сотни ископаемых остатков, принадлежащих представителям нескольких групп млекопитающих, в том числе относящихся к древнейшим стволовым плацентарным. Численно доминируют остатки плацентарных, принадлежащие двум видам рода прокенналестов — маленьким зверькам, питавшимся в основном насекомыми и другими наземными беспозвоночными животными. Прокенналест малый (Prokennalestes minor) не превышал величиной современных землероек среднего размера. Прокенналест Трофимова (Prokennalestes trofimovi) был приблизительно на четверть больше. В коллекциях Палеонтологического института имени А. А. Борисяка РАН в Москве и Геологического института Академии наук Монголии в Улан-Баторе хранятся более 500 экземпляров их челюстей и зубов, примерно поровну от каждого вида. Раскопочные работы в урочище Ховур велись Совместной Советско-Монгольской палеонтологической экспедицией в 1969–1971 гг. и возобновились Совместной Российско-Монгольской палеонтологической экспедицией в 2012 г. в новой точке — Зун-Ховур [13].
Детальное исследование всех образцов прокенналестов из Ховура позволило нам получить первые статистически достоверные результаты по изменчивости признаков столь древних млекопитающих на массовом материале (как мы уже отмечали, обычно находки раннемеловых эутериев единичны, если не уникальны) [14]. Также нами описан еще один вид плацентарных, названный ховурлестом (Hovurlestes noyon). Он отличается от прокенналестов более крупными клыками и наличием на коренных зубах маленького бугорка, усиливающего межзубное сцепление [15].
На внутренней стороне нижнечелюстных костей прокенналестов (и других раннемеловых эутериев) есть характерный для древних млекопитающих признак — отчетливая меккелева борозда. Это тянущийся вдоль нижнего края кости длинный, узкий и неглубокий желобок, служивший для прикрепления передней части окостенелого меккелева хряща, к заднему концу которого были подвешены слуховые косточки. У взрослых современных млекопитающих слуховые косточки находятся в полости среднего уха и полностью обособлены от нижней челюсти, но в эмбриогенезе рекапитулируется описанное состояние, свойственное прокенналестам и многим другим мезозойским млекопитающим [16]. Резорбция меккелева хряща у современных млекопитающих обеспечивается специальными клетками — хондрокластами. Если по генетическим или фармакологическим причинам хондрокласты утрачиваются, эмбриональный меккелев хрящ сохраняется и окостеневает на взрослой стадии, формируя на нижней челюсти отчетливую борозду [17]. Эволюционный переход к «современному» состоянию косточек среднего уха происходил у плацентарных и сумчатых независимо. Эти преобразования способствовали усилению передаваемого звукового сигнала, увеличивая остроту слуха. Вероятно, они были сопряжены с увеличением и усложнением головного мозга.
Вряд ли факт подавляющего численного превосходства остатков прокенналестов в Ховуре связан с условиями захоронения или особенностями распространения тех или иных групп млекопитающих. По геологическим данным, все эти зверьки вместе с многочисленными ящерицами и мелкими динозаврами жили по берегам озер и проток, существовавших в раннемеловую эпоху на месте нынешней пустыни Гоби, и одновременно гибли во время сезонных наводнений. Тонкие кости их челюстей со слабо закрепленными в альвеолах зубами не вынесли бы переноса водными потоками на большое расстояние. Видимо, массовость остатков прокенналестов действительно отражает их обилие в древнем биоценозе.
Можно предположить, что представители архаичных групп млекопитающих росли несколько медленнее и жили дольше современных зверей такого же размера. Такую «жизненную стратегию» они унаследовали от своих предков — цинодонтов, имевших замедленный по сравнению с современными млекопитающими ювенильный рост и более продолжительный рост у взрослых особей [18]. Анализ возрастной индивидуальной изменчивости у представителей архаичного рода Morganucodon по высоте зубной кости нижней челюсти показал, что переход к свойственной млекопитающим модели произошел уже на эволюционном уровне морганукодонтов в позднетриасовую эпоху, т.е. сразу же при появлении млекопитающих [18]. Однако некоторые ранние млекопитающие сочетали быстрый ювенильный рост и некоторое его замедление у взрослых особей. Например, хищные триконодонты рода гобиконодонов (Gobiconodon), достигавшие размеров енота, продолжали активно расти и во взрослом состоянии. При этом у них несколько раз за жизнь сменялись коренные зубы, обеспечивая возможность нормально питаться, несмотря на снашивание зубных коронок [19].
Для млекопитающих в целом характерно сочетание быстрого ювенильного роста с детерминированной остановкой роста при достижении взрослого состояния. Еще предки плацентарных, стволовые териевые млекопитающие, приобрели совершенную зубную систему, называемую трибосфенической [20]. При таком строении зубов внутренний бугорок на верхних молярах взаимодействует с углубленным задним выступом на нижних молярах по принципу пестика в ступке, что позволяет эффективно обрабатывать пищу путем ее перетирания и в итоге дает значимые энергетические преимущества. Вероятно, древние плацентарные производили быстро созревавшее потомство, достигавшее взрослой стадии скорее, чем в других группах. Можно предположить, что с этим связана массовость находок плацентарных в таких местонахождениях, как Ховур и Зун-Ховур.
Большинство найденных остатков обоих видов прокенналестов принадлежат взрослым особям, у которых молочные зубы уже сменились на постоянные; при этом средний из пяти премоляров оставался молочным во взрослом состоянии либо выпадал без соответствующей замены [13]. У более поздних эутериев (начиная с сасаямамила) этот зуб вообще исчезает, и в каждой половине челюсти остается только по четыре премоляра. Не исключено, что сокращение числа предкоренных зубов эволюционно связано с ускорением онтогенеза. У современных землероек, живущих всего лишь 1,5 года и становящихся самостоятельными в четырехнедельном возрасте, смены зубов не происходит, так как закладки молочных зубов резорбируются еще на эмбриональной стадии.
Отсутствие остатков молоди прокенналестов в Ховуре может свидетельствовать о низкой ювенильной смертности и указывать на высокий уровень заботы о потомстве, характерный для так называемой K-стратегии размножения, при которой относительно низкая численность приплода компенсируется высоким уровнем его доживания до взрослого состояния. Противоположна ей r-стратегия, суть которой состоит в производстве многочисленного потомства, как правило быстро достигающего самостоятельности и широко расселяющегося, но подверженного высокой смертности в ювенильном возрасте.
Следует также отметить, что с репродуктивно обусловленным усилением метаболизма первично могло быть связано развитие совершенной теплокровности у плацентарных [21].
***
В итоге можно предположить, что начало эволюционного успеха предковых плацентарных было связано не только с физиологическими преимуществами, обусловленными совершенствованием зубной системы, органов чувств и теплокровности, но и с новой стратегией размножения, включающей относительно длительное эмбриональное созревание, быстрый ювенильный рост, ускоренное взросление и развитую заботу о потомстве.
Последующая эволюционная история плацентарных млекопитающих в меловом периоде на всех северных континентах отражена многочисленными находками весьма разнообразных форм мелкого размера, среди которых преобладали группы, полностью угасшие еще до начала кайнозойской эры. Меловых млекопитающих, явно относящихся к кроновой группе плацентарных, пока неизвестно. Однако при этом уже в первой половине палеоцена отмечается взрывное увеличение разнообразия плацентарных и появление предков некоторых современных таксонов уровня отрядов и надотрядов (в частности, насекомоядных, хищных, копытных, грызунов, приматов, шерстокрылов). Данные молекулярной биологии свидетельствуют, что ответвление основных крупных групп современных Placentalia произошло более 65 млн лет. Поэтому прослеживание филетических линий современных отрядов плацентарных и предковых для них групп в поздний мел потенциально возможно.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 16-04-00294).
Литература
1. Bininda-Emonds O. R. P., Cardillo M., Jones K. E. et al. The delayed rise of present-day mammals // Nature. 2007; 446(7219): 507–512.
2. Luo Z.-X., Yuan C.-X., Meng Q.-J., Ji Q. A Jurassic eutherian mammal and divergence of marsupials and placentals // Nature. 2011; 76(7361): 442–445.
3. Bonnan M. F., Shulman J., Varadharajan R. et al. Forelimb kinematics of rats using XROMM, with implications for small eutherians and their fossil relatives // PLoS One. 2016; 11(3): e0149377.
4. Averianov A. O. Taxonomic revision of tribosphenic mammals from the Lower Cretaceous Antlers Formation of Texas and Oklahoma, USA // Proceedings of the Zoological Institute RAS. 2015; 319: 141–181.
5. Davis B. M., Cifelli R. L. Reappraisal of the tribosphenidan mammals from the Trinity Group (Aptian — Albian) of Texas and Oklahoma // Acta Palaeontologica Polonica. 2011; 56(3): 441–462.
6. Cifelli R. L., Davis B. M. Tribosphenic mammals from the Lower Cretaceous Cloverly Formation of Montana and Wyoming // Journal of Vertebrate Paleontology. 2015; 35(3): e920848.
7. Sweetman S. C., Smith G., Martill D. M. Highly derived eutherian mammals from the earliest Cretaceous of southern Britain // Acta Palaeontologica Polonica. 2017; 62(4): 657–665.
8. Ji Q., Luo Z.-X., Yuan C.-X., et al. The earliest known eutherian mammal // Nature. 2002; 416(6883): 816–822.
9. Brawand D., Wahli W., Kaessmann H. Loss of egg yolk genes in mammals and the origin of lactation and placentation // PLoS Biol. 2008; 6(3): e63.
10. Hu Y., Meng J., Li C., Wang Y. New basal eutherian mammal from the Early Cretaceous Jehol biota, Liaoning, China // Proceedings of the Royal Society. Series B. 2010; 277: 229–236.
11. Averianov A. O., Skutschas P. P. A new genus of eutherian mammal from the Early Cretaceous of Transbaikalia, Russia // Acta Palaeontologica Polonica. 2001; 46(3): 431–436.
12. Kusuhashi N., Tsutsumi Y., Saegusa H. et al. A new Early Cretaceous eutherian mammal from the Sasayama Group, Hyogo, Japan // Proceedings of the Royal Society. Series B. 2013; 280(1759): e 20130142.
13. Лопатин А. В. Новые находки раннемеловых млекопитающих в Монголии // Доклады Академии наук. 2013; 449(4): 491–493.
14. Lopatin A. V., Averianov A. O. The stem placental mammal Prokennalestes from the Early Cretaceous of Mongolia // Paleontological Journal. 2017; 51(12): 1293–1374.
15. Лопатин А. В., Аверьянов А. О. Новое стволовое плацентарное млекопитающее из раннего мела Монголии // Доклады Академии наук. 2018; 478(1): 117–120.
16. Лопатин А. В. Происхождение и ранние этапы эволюции млекопитающих: современное состояние проблемы // Эволюционная и функциональная морфология позвоночных. М., 2017: 182–189.
17. Anthwal N., Urban D. J., Luo Z.-X et al. Meckel’s cartilage breakdown offers clues to mammalian middle ear evolution // Nature Ecology & Evolution. 2017; 1(Art. № 0093): 1–6.
18. O’Meara R. N., Asher R. J. The evolution of growth patterns in mammalian versus nonmammalian cynodonts // Paleobiology. 2016; 42(3): 439–464.
19. Lopatin A. V., Averianov A. O. Gobiconodon (Mammalia) from the Early Cretaceous of Mongolia // Journal of Mammalian Evolution. 2015: 22(1): 17–43.
20. Lopatin A. V., Averianov A. O. An aegialodontid upper molar and the evolution of mammal dentition // Science. 2006: 313(5790): 1092.
21. Levesque D. L., Lovegrove B. G. Increased homeothermy during reproduction in a basal placental mammal // Journal of Experimental Biology. 2014; 217: 1535–1542.
Статья на конкурс «био/мол/текст»: Эволюция млекопитающих длится уже около 250 млн лет. Наибольшее распространение и разнообразие среди этой группы животных получили плацентарные. Визитная карточка этой группы животных — плацента — считается самым «молодым» органом в истории позвоночных. Также наибольшее разнообразие структур плаценты встречается именно у плацентарных, хотя, в отличие от других позвоночных, у них плацента возникла единожды у общего предка. У рыб, чешуйчатых и земноводных в примитивной форме плацента возникала независимо и многократно. Самой ранней находкой ученых в этой области признаны окаменелости рыбы с эмбрионом и пуповиной (их примерный возраст 380 млн лет).
С развитием молекулярных методов ученые стали интенсивно изучать генетические механизмы появления и развития плаценты и использовать накопленные знания для изучения возникновения других органов. В статье рассмотрены три таких механизма, повлиявших на развитие плаценты: захват ретровирусных элементов геномом некоторых позвоночных; создание семейств генов путем дупликации; эволюция нуклеотидных последовательностей, регулирующих работу генов. Также приведены яркие примеры молекулярной эволюции некоторых генов и промоторов. При этом сделан упор на такую важную характеристику плаценты, как инвазивность.
Немного об уникальности
Естественный отбор построен на том, что однажды возникшее эволюционное новшество оказывается преимуществом, и вид, им обладающий, выживает в условиях, в которых другие погибают. Говоря об эволюционных преимуществах, вспоминаются в первую очередь такие примеры, как развитие сложно устроенного мозга, появление большого пальца, крыльев, жабр и др. Одно из таких преимуществ — плацента, изучением развития которой уже давно занимаются многие ученые по всему миру. Чем же так завораживает их эта область науки?
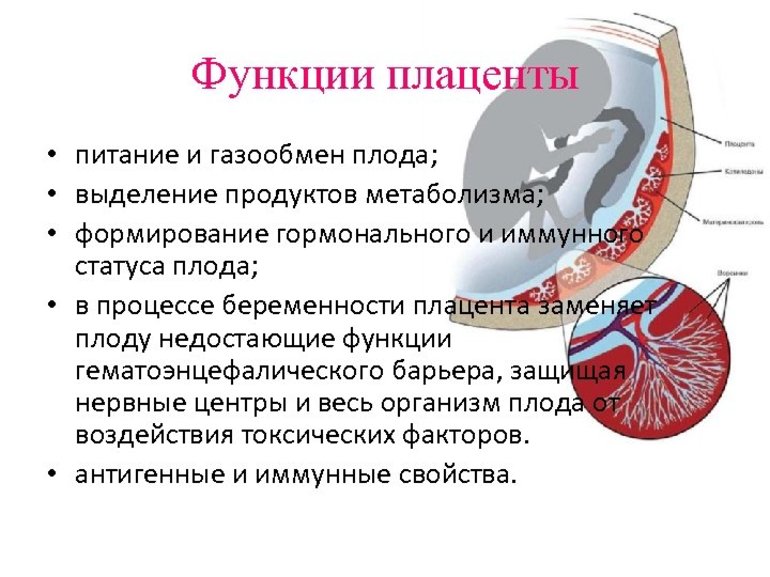
- Плацента
- временный орган, формирующийся во время беременности из тканей эмбриона и матери (в редких случаях — отца, см. далее). Основная функция плаценты — обеспечить развивающийся плод питанием и кислородом за счет родительского организма. В некоторых случаях, например у человека, плацента приобретает новую функцию: обеспечить защиту для плода от нападок иммунной системы матери. Ведь по своей сути плод является для организма матери чужеродным биологическим объектом.
Физиологически плацента уникальна тем, что существует только во время вынашивания плода и формируется каждый раз при новой беременности. Это единственный орган, который состоит из тканей двух разных организмов: матери и плода.
Эволюционно уникальность плаценты в том, что она возникала независимо и многократно в параллельно развивающихся линиях животных [1]. Также, по сравнению с остальными органами, эволюция плаценты произошла относительно недавно [2], и формы, в которых она явилась миру, настолько разнообразны, что проследить ее эволюцию не так уж и просто. Но ученые не сдаются, и каждый год при исследовании генов, работающих в клетках плаценты, появляются новые интересные факты, помогающие объяснить историю и диверсификацию многих групп животных. Также генетические механизмы возникновения плаценты изучаются как своего рода модель происхождения других органов.
Часть 1. Эволюция плаценты: от живорождения к сложнейшим формам плацентотрофии
Всё разнообразие и многогранность форм жизни, что мы можем наблюдать сегодня, просто выглянув в окно или путешествуя по экзотическим странам, произошло от первых самовоспроизводящихся молекул (согласно гипотезе мира РНК [3], [4]) и развивалось в течение миллиардов лет [5]. Любые важные эволюционные новшества, будь то гены, клетки, ткани или органы, также имеют долгую историю своего развития, начинать рассказывать которую необходимо с предпосылок их появления.
Формированию плаценты предшествовал переход от внешнего оплодотворения к внутреннему, от яйцекладки к живорождению. В этой части мы рассмотрим возникновение живорождения у позвоночных, перейдем к многочисленным формам плацентотрофии (одному из способов, обеспечивающих внутриутробное питание плода) у этих животных, и остановимся более подробно на плацентарных — наиболее многочисленной группе млекопитающих с самой интересной и богатой историей развития такого интересного органа, как плацента.
Живорождение
- Живорождение
- это один из способов репродукции как у позвоночных (млекопитающие, рыбы, птицы, амфибии), так и беспозвоночных животных (насекомые, черви), при котором развитие плода происходит внутри организма родителя, и потомство появляется на свет без оболочек яйца.
История развития позвоночных насчитывает более 520 миллионов лет. Считается, что живорождение у них возникло 380 млн лет назад, и связана эта дата с окаменелостью, найденной в Австралии в 2005 году. Ученые обнаружили представителя древних вымерших пластинокожих рыб (рис. 1) с хорошо сохранившимися костями эмбриона и пуповиной. Жила эта рыбка в девонский период палеозойской эры, 380 млн лет назад. И на данный момент это самый древний из найденных представителей живородящих позвоночных [6].
Рисунок 1. Пластинокожая рыба, найденная в Австралии. а — Реконструкция Materpiscis attenboroughi с потомством. б — Окаменелости Materpiscis attenboroughi (красным цветом отмечена пуповина; зеленым — кости эмбриона; желтым — следы желточного мешка).
Рисунок 2. Количество возникновений живорождения в разных группах позвоночных. Чаще всего живорождение возникало у рептилий — 115 раз; у млекопитающих это случилось единожды, но зато привело к большому разнообразию форм плаценты.
Живорождение является одним из наиболее впечатляющих примеров параллельной (конвергентной) эволюции у позвоночных, при которой происходит независимое развитие органа или признака у организмов разных систематических групп. Живорождение в различных родословных позвоночных независимо возникало около 150 раз (рис. 2). Для сравнения, некоторые другие эволюционные новшества возникали не так часто: лактация — один раз; теплокровность — три раза [1].
Перешедшие на живорождение виды получили преимущества для выживания потомства в неблагоприятных условиях: в холодное время плод находился внутри тела в тепле, был защищен от съедания хищниками, в то время как оставленное без присмотра яйцо — легкая добыча для них.
Существуют также яйцеживородящие виды (например, некоторые ящерицы), у которых плод внутриутробно развивается в яйце, там же высвобождается от яйцевых оболочек и появляется на свет уже без них. В таком случае его питание обеспечивает запас веществ, находящихся в желтке яйца. При обычном живорождении питание обеспечивается за счет организма матери — матротрофии.
Матротрофию не стоит путать с плацентотрофией, так как матротрофия может осуществляться разными способами: эмбриофагия («фагия» — поедание), оофагия, гистофагия, гистотрофия, плацентотрофия.
Интересный случай эмбриофагии встречается у акулообразных: у тигровой песчаной акулы питание эмбриона происходит за счет внутриутробного каннибализма. На определенной стадии развития будущий акулёнок поглощает всех братьев и сестер, развивающихся в его яйцеводе. После чего в течение нескольких месяцев внутриутробного развития питается новыми образующимися яйцеклетками (оофагия) [7].
Но мы остановимся на плацентотрофии — внутриутробном питании плода через плаценту.
Плацентотрофия
Очень точное определение плаценты, на которое обычно ссылаются ученые при изучении различных видов животных, придумал Моссман: плацента — это прикрепление (или слияние) плодных оболочек к тканям родителя для физиологического обмена [8]. Согласно этому определению, плацента есть не только у плацентарных. И у других групп этот орган образуется, но в более примитивном виде. Рассмотрим такие структуры.
Большинство чешуйчатых позвоночных (змеи, ящерицы) откладывают яйца, и плацента у них не образуется. Но есть, например, шесть видов ящериц семейства сцинковых, у которых развита плацентотрофия (рис. 3) [1].
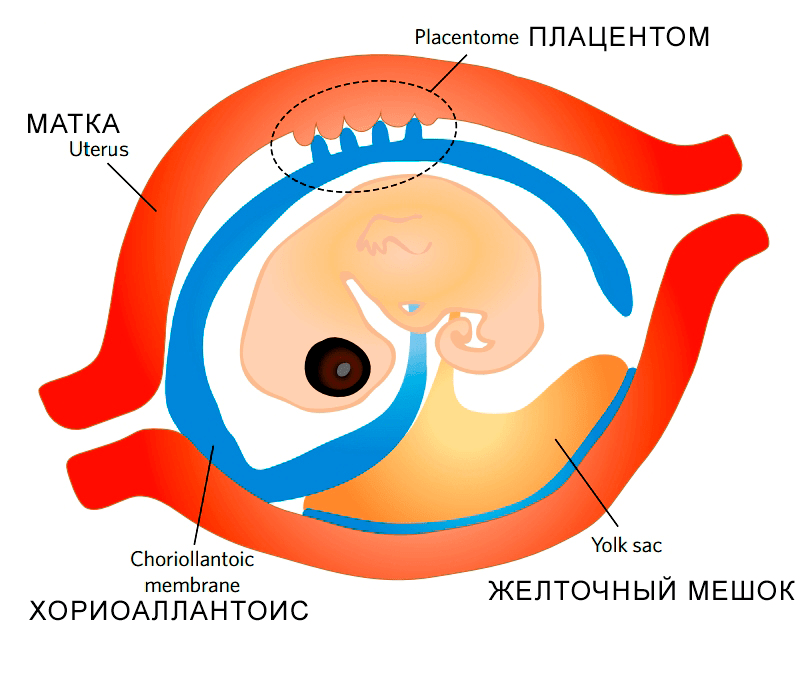
Рисунок 3. Плацентация у чешуйчатых. Плацентом — место тесного контакта тканей матери и эмбриона; складки плацентома увеличивают поверхность контакта, и поток питательных веществ, передающихся эмбриону, возрастает.
Среди земноводных очень необычный механизм плацентотрофии с участием кожных зубов (рис. 4) плода сформировался у водных червяг (не путать с червяками) — Typhlonectes compressicauda. На одной из стадий развития эмбриона у него появляются хорошо снабжающиеся кровью жабры. Чтобы сократить расстояние и создать плотный контакт между капиллярами жабр и капиллярами яйцевода, он соскабливает поверхностный слой яйцевода своими кожными зубами [9].
Рисунок 4. Кожные зубы у взрослого червяги
У рыб встречаются плаценты, которые формируются в результате близкого расположения эмбриональных и родительских тканей, тесно контактирующих либо по всей поверхности оболочек эмбриона, либо с наиболее выпирающими частями (рис. 5).
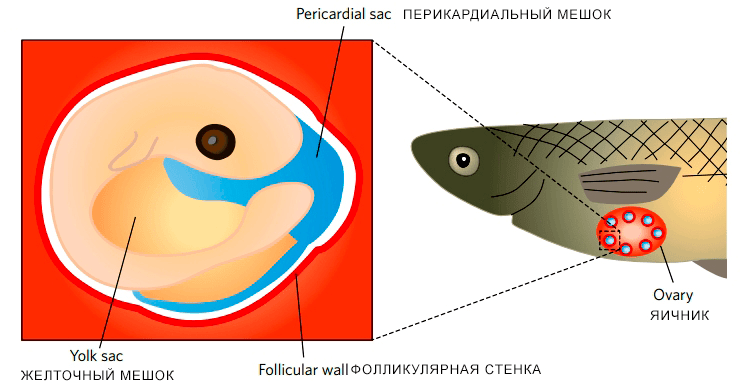
Рисунок 5. У пецилиевых рыб плацента формируется в яичниках в месте выступающих тканей эмбриона
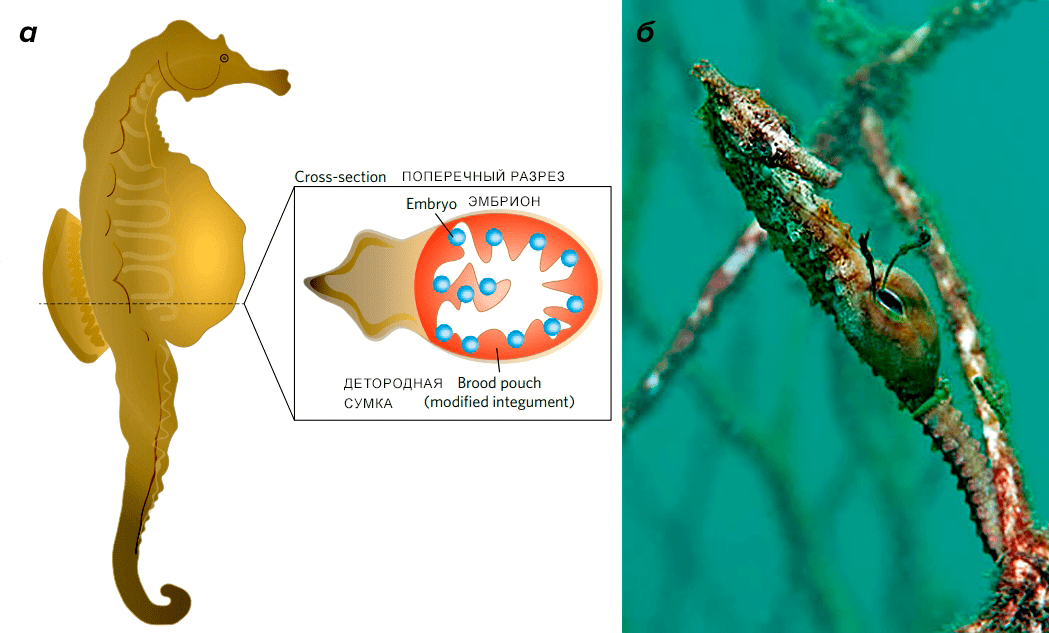
Невозможно обойти стороной и яркий пример того, как самец морского конька вынашивает потомство. У представителей мужского пола этого рода иглообразных рыб на брюшке образуется кожная складка, куда самка мечет икринки, после чего из кожной складки образуется хорошо снабжающаяся кровью сумка с плацентоподобной структурой, в которой развиваются эмбрионы (рис. 6) [2].
Рисунок 6. Самец морского конька вынашивает потомство в кожной сумке на брюшке. а — Поперечный разрез сумки с эмбрионами. б — Фотография самца морского конька с потомством.
У яйцекладущих млекопитающих (уткнос, ехидна) высоко развита матротрофия: питательные вещества поглощаются через пористую яичную скорлупу [1]. Но плаценты у них нет, хотя некоторые авторы и рассматривают такой способ питания, как плацентотрофию. У остальных млекопитающих плацентотрофия — единственный способ внутриутробного питания потомства. И хоть сумчатых не относят к плацентарным, в течение беременности у них этот орган всё же формируется. Их плацента гораздо примитивнее, чем у плацентарных, и существует очень непродолжительный период времени [10].
Таким образом, живорождение, появившееся параллельно и независимо у разных групп животных, привело к образованию различных способов внутриутробного питания эмбрионов, среди которых — плацентотрофия. Этот способ оказался «выгоден» для большого количества животных, но наибольшее структурное разнообразие плацента получила именно у плацентарных.
Однажды в Палеоцене: развитие плацентарных
Как уже было отмечено, формирование плаценты — это постепенный процесс, идущий одновременно с эволюцией мира животных. Развитие млекопитающих длилось около 250 млн лет (рис. 7) [11]: от первых общих предков млекопитающих, которые жили в начале триасового периода, до ныне живущих отдельных групп: плацентарных (ок. 5100 видов), сумчатых (ок. 250 видов) и однопроходных (5 видов).
Рисунок 7. Филогенетическое дерево млекопитающих. Красная вертикальная линия (K/Pg boundary) — граница перехода от эры мезозоя к кайнозою (65 млн лет назад), ассоциированная с массовым вымиранием многих животных, в том числе нептицеподобных динозавров. Среди плацентарных млекопитающих только один стволовой таксон пересек эту границу. Большинство плацентарных развилось в палеоцене в период от 200 до 400 тысяч лет после красной линии.
По рисунку выше видно, что из всех млекопитающих со временем наибольшее распространение получили плацентарные. Их расцвет начался в эпоху палеоцена спустя некоторое время после массового вымирания нептицеподобных динозавров, которое в свою очередь произошло 65 млн лет назад [11]. Считается, что после вымирания наземных динозавров освободились многие экологические ниши для развития млекопитающих, ими осваивались новые территории, появлялись новые виды. Началась новая эра — эра млекопитающих.
Эволюционные биологи для построения древа жизни любой группы живых организмов вычисляют последнего общего предка этой группы, который является основанием древа. От основания отходят ветви, ведущие к новым видам и устанавливающие эволюционные связи между ними. Так как общий предок всех млекопитающих не имел плаценту и откладывал яйца, то для изучения эволюции плаценты важным шагом было определение последнего общего предка плацентарных и его биологические характеристики.
В 2013 году ученые с поражающей точностью описали физиологию и реконструировали внешность (рис. 
Рисунок 8. Реконструкция внешности предполагаемого последнего общего предка плацентарных
Когда же жил этот вид и застал ли он существование наземных динозавров, либо появился уже после их исчезновения? Этот важный для понимания эволюции вопрос остается открытым и является предметом горячего обсуждения ученых [11–13].
Тем не менее важная веха в эволюции плаценты была поставлена во время возникновения последнего общего предка плацентарных. И хоть плацента в этой группе возникла единожды, она получила у них наибольшее разнообразие и структурную сложность.
Разнообразие форм плаценты у плацентарных
Даже внутри близкородственных видов структуры плаценты могут отличаться по трем важным параметрам:
- по форме контактирующих участков тканей матери и плода (рис. 9);
- по способу разветвления тканей плода в тканях матки (рис. 10);
- по степени глубины внедрения эмбриона в ткани матки — инвазивности плаценты (рис. 11а и б).
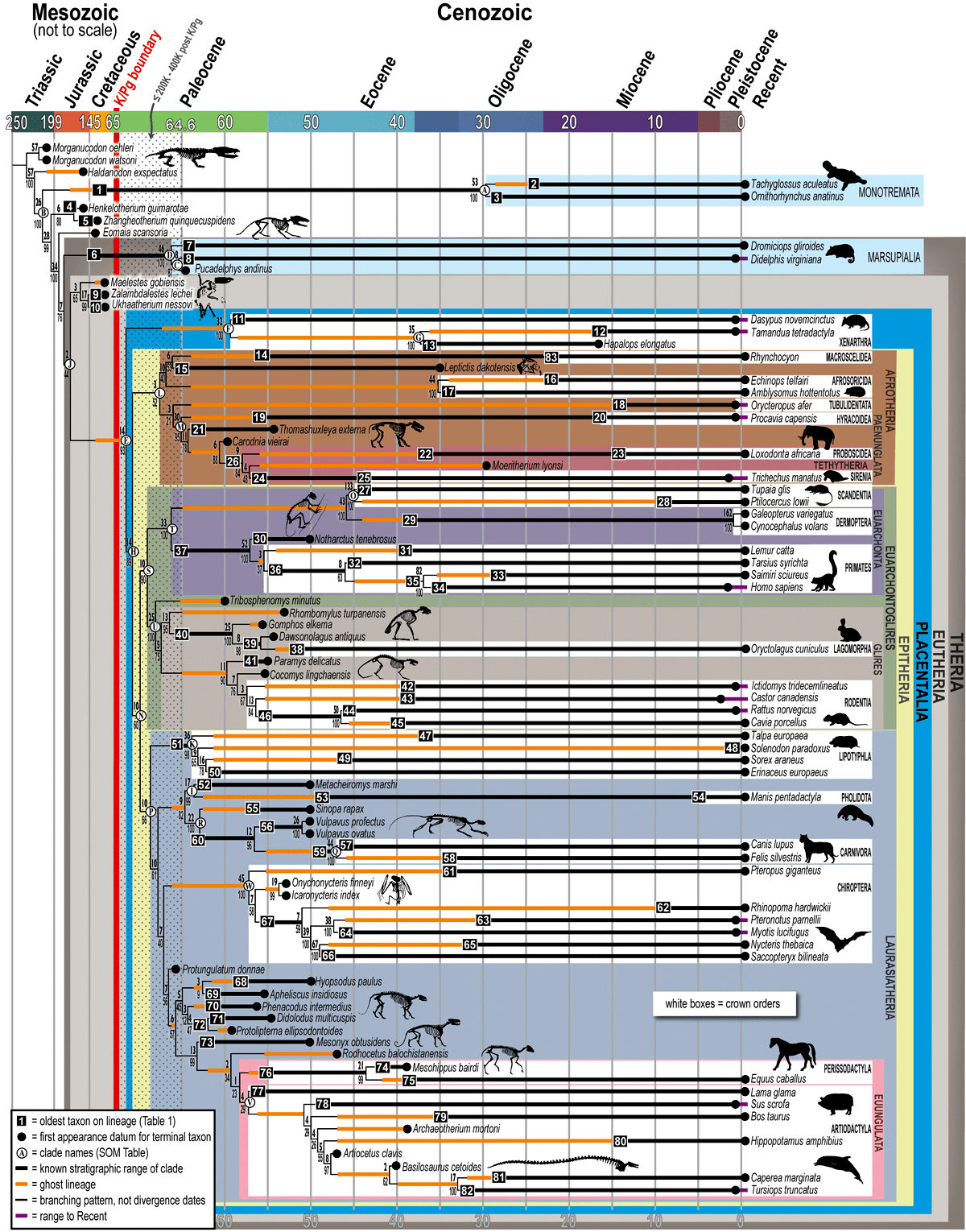
Рисунок 9. Типы плацент по форме контактирующих участков тканей матери и плода у плацентарных млекопитающих: диффузная (ворсинки — длинные выросты эмбриональной части плаценты — расположены по всей поверхности хориона), котиледонная (ворсинки образуют островки), зонарная (ворсинки в средней части образуют пояс), дискоидная (ворсинки образуют диск). Желтый и оранжевый цвета — внешние эмбриональные ткани.
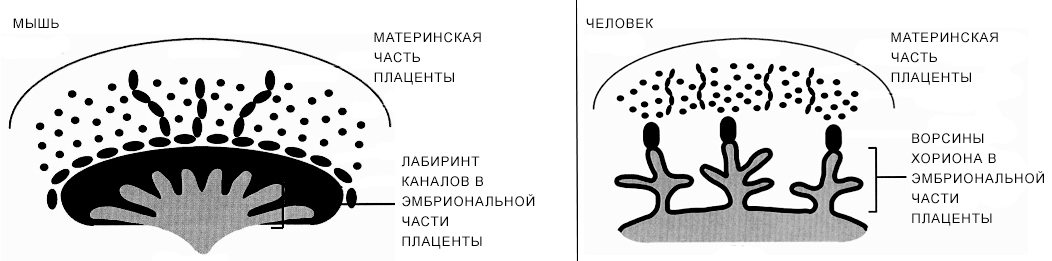
Рисунок 10. Сравнительная анатомия ворсинчатой плаценты человека и лабиринтной плаценты мыши. Площадь контакта материнских и эмбриональных тканей увеличивается за счет сильного разветвления ворсин хориона у человека и за счет лабиринта каналов у мыши.
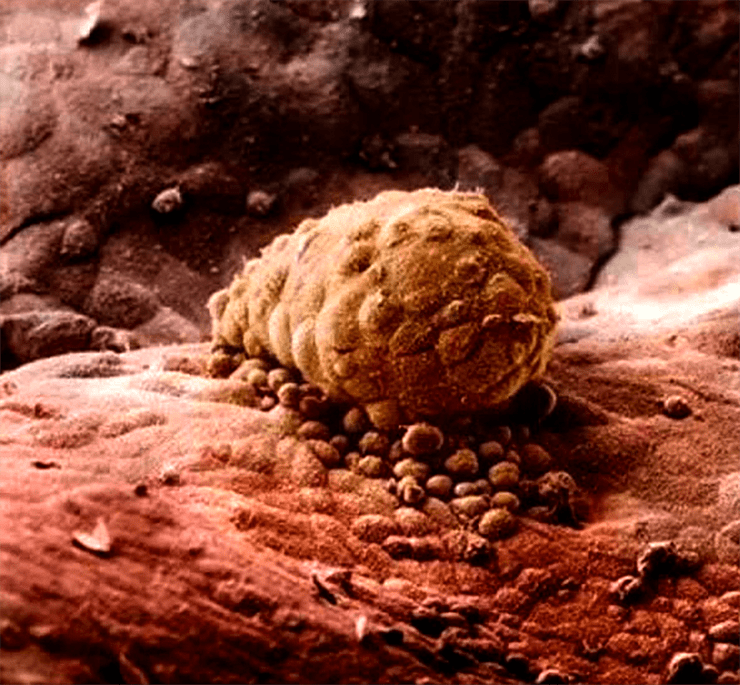
Рисунок 11а. Фотография имплантации (внедрения в матку) зародыша из книги A Child is Born Леннарта Нильсона
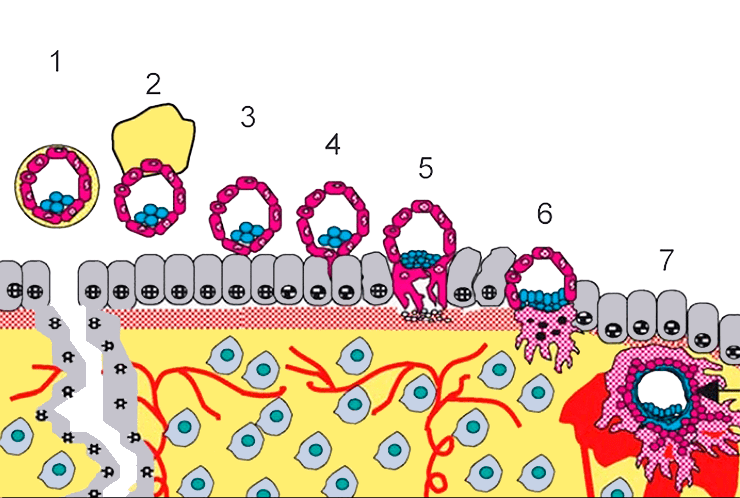
Рисунок 11б. Этапы имплантации эмбриона в ткани матки, предшествующие формированию плаценты. 1 — образование бластоцисты; 2 — выход бластоцисты из внешней оболочки (хэтчинг); 3 — прикрепление (адгезия); 4, 5, 8 — проникновение (инвазия) с образованием синцитиотрофобласта; 7 — формирование ворсин хориона.
Разумеется, классифицируют всё разнообразие плацент и по другим параметрам [16]. Но большое внимание в исследованиях уделяется именно инвазивности плаценты и самому процессу имплантации эмбриона.
Имплантация, при которой эмбрион «зарывается» вглубь тканей матки, разрушая ее верхние слои (рис. 11), противопоставляется прикреплению, при котором эмбрион остается на поверхности, не разрушая эпителий (поверхностный слой) матки и формируя неинвазивную плаценту (рис. 12).
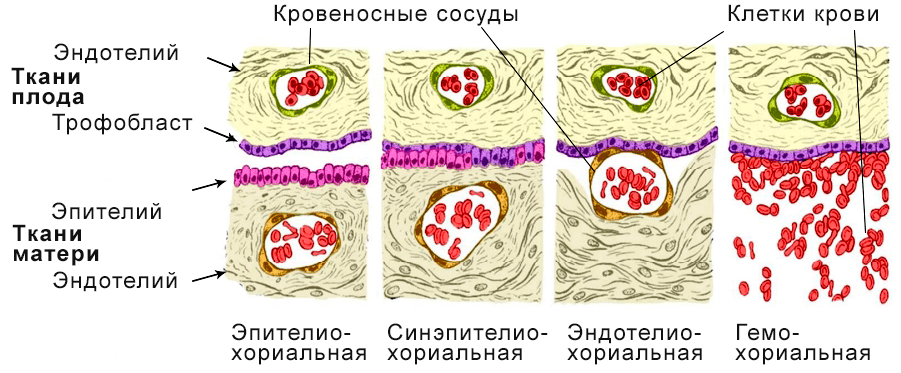
Рисунок 12. Классификация плаценты по степени инвазии, где самая неинвазивная плацента — эпителиохориальная, а наиболее инвазивная — гемохориальная. В последнем случае эмбрион внедряется вглубь тканей матки, а его внешние оболочки разрушают кровеносные сосуды матери и начинают омываться ее кровью, обеспечивая физиологический обмен различными молекулами.
Как думаете, какая из четырех типов плацент, указанных на рисунке 12, была у первого плацентарного млекопитающего? Логично предположить, что для предка подходит просто устроенный неинвазивный эпителиохориальный тип. А потом уже в процессе эволюции могло бы произойти усложнение структуры плаценты и образоваться инвазивный гемохориальный тип, как у человека.
Такого очевидного хода событий придерживались до недавнего времени. Но это ошибочное представление, и несколько ученых доказали обратное.
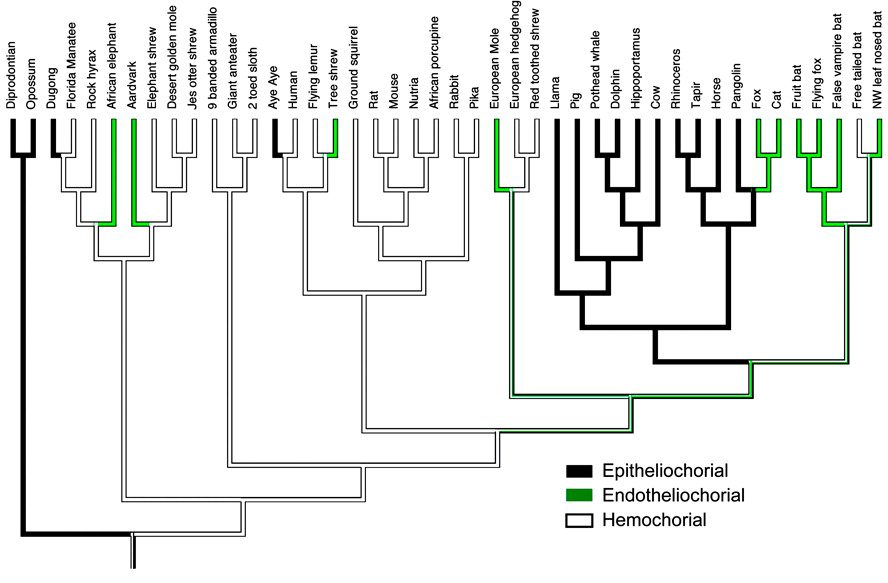
Оказалось, у предка плацентарных была инвазивная гемохориальная плацента [18], [19]. Эпителиохориальная же плацента — это ее производная форма, которая возникала независимо трижды в различных группах плацентарных, самая многочисленная из которых — жвачные (рис. 13).
Рисунок 13. Схема эволюции инвазивности плаценты: эпителиохориальная — черный цвет; гемохориальная — белый цвет; эндотелиохориальная — зеленый цвет
Важнейшие шаги в эволюции плаценты плацентарных
Как уже сказано, предок плацентарных был маленьким зверьком. Большинство плацентарных развивалось в направлении увеличения размеров и массы тела. Сейчас представители плацентарных имеют массу тела от 1,5 граммов (свиноносая летучая мышь) до 190 000 кг (синий кит) [20].
В свою очередь, увеличение размеров родителя влекло за собой и увеличение размеров потомства, что потребовало увеличения продолжительности сроков беременности. Анатомически длительное вынашивания плода стало возможно с исчезновением надлобковой кости, которая не позволяла расширять живот при беременности [21]. Плацентарные — единственные млекопитающие, у которых эта кость редуцировалась, сохранившись лишь у некоторых представителей в виде косточки пениса — бакулюма. Предвидя ваш вопрос, отмечу, что у человека бакулюма нет.
Превратить врага в друга: воспалительную реакцию в противовоспалительную
Еще одним барьером к продолжительной беременности является воспалительная реакция на появление в матке генетически чужеродного объекта. Воспалительная реакция при беременности, или острое эндометриальное воспаление, — это древняя естественная материнская реакция на прикрепление эмбриона [22]. Такое воспаление до сих пор наблюдается у сумчатых. У них беременность очень короткая, эмбрион бóльшую ее часть остается не прикрепленным к матке. Прикрепление происходит лишь в конце беременности, вызывая воспаление, которое запускает процесс родов [10]. У опоссумов, например, эмбрион с момента оплодотворения развивается внутри тела матери всего 14 дней. На 12-й день он прикрепляется к матке, начинается воспалительная реакция, и через два дня происходят безболезненные роды, после которых плод развивается в сумке матери.
Физиологически долгая беременность у плацентарных стала возможна при «изобретении» способа, помогающего избежать иммунологического конфликта матери и плода. Такой механизм противовоспалительной реакции запрограммирован в децидуальных клетках [23]. Но стоит отметить, что воспаление остается необходимым для имплантации эмбриона в начале беременности, а в конце — для запуска родового процесса [10].
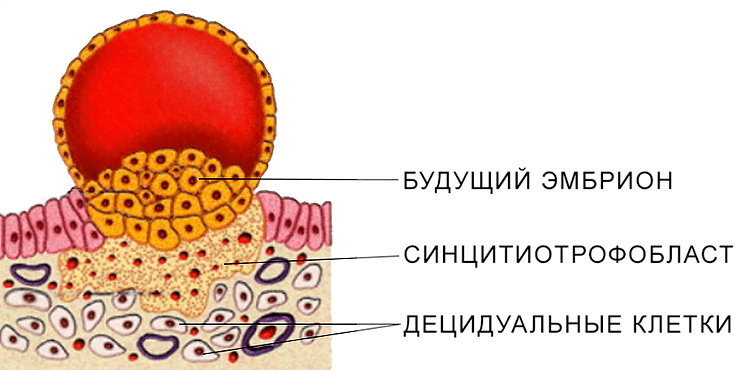
Итак, децидуальные клетки — это очень крупные клетки (рис. 14), образующиеся в матке плацентарных либо каждый менструальный цикл вне зависимости от беременности (как у человека), либо в качестве ответа на сигналы эмбриона (как у мыши). Процесс их образования называется децидуализацией.
Рисунок 14. Схематическое изображение одной из стадий имплантации. Показаны децидуальные клетки.
Появление децидуальных клеток в эволюции — важнейший шаг для развития плаценты, позволяющий превратить врага в друга, воспалительную реакцию в противовоспалительную [22].
Децидуальные клетки формируют децидуа — ткань матки, непосредственно контактирующую с эмбриональными тканями и выполняющую важнейшую функцию подавления иммунного конфликта между матерью и плодом. Она также контролирует разрастание тканей эмбриона, не позволяя им бесконтрольно внедряться и захватывать чужую для них территорию. Этот аспект очень важен в медицине, так как сбой в системе материнского контроля над имплантацией эмбриона и сильное его проникновение в матку у человека ведет к патологическому состоянию, угрожая жизни женщины. Обратное явление недостаточной инвазии эмбриона также опасно, так как может привести к прерыванию беременности и гибели плода на любом сроке [24], [25].
Исследования показывают, что децидуальные клетки появились еще у последнего общего предка плацентарных и характерны только для этой группы животных [26]. Молекулярное доказательство этого факта основано на изменении важного участка ДНК, регулирующего работу важного гена децидуализации FOXO1. И этот процесс мы подробнее разберем во второй части статьи. А пока перейдем к следующему не менее важному шагу в эволюции плаценты — образованию новой ткани эмбриона — трофобласту.
Трофобласт
- Трофобласт
- это внешняя оболочка зародыша млекопитающих, которая участвует в образовании плаценты вместе с материнскими тканями.
У птиц, многих рептилий и яйцекладущих млекопитающих запас питательных веществ для развития эмбриона находится в желтке яйца. С появлением живорождения и исчезновением твердых яичных оболочек в яйцеклетке снижается количество желтка. Соответственно, запас питательных веществ, необходимый для развития плода, сокращается. У млекопитающих появляется другой механизм внутриутробной «добычи пищи».
После нескольких дней оплодотворения яйцеклетки в результате клеточного деления формируется наружный клеточный слой — трофобласт (рис. 15) — и внутренняя клеточная масса — будущий эмбрион. Именно трофобласт берет на себя функцию «охотника» за материнскими питательными молекулами для растущего эмбриона [27].
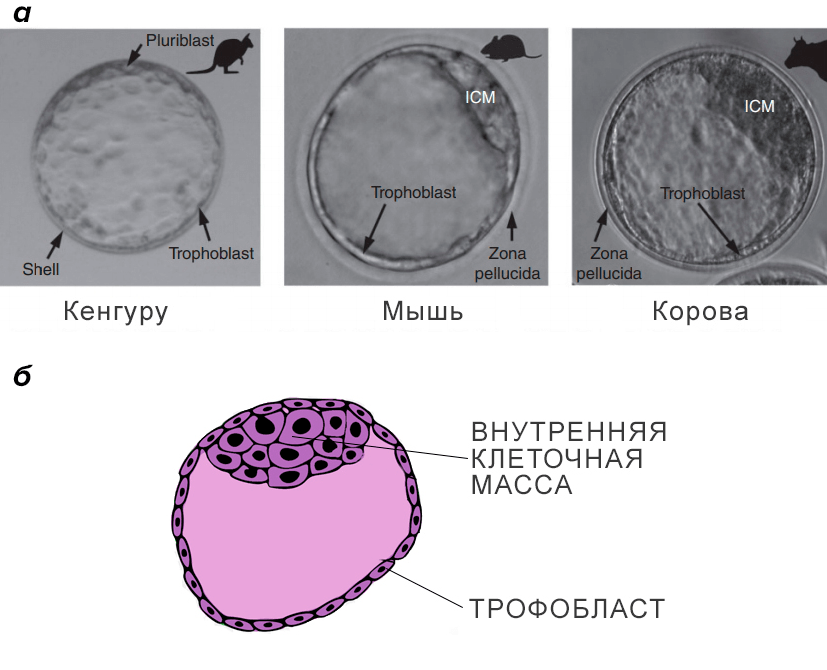
Рисунок 15. Бластоциста и трофобласт. а — Фотография бластоцисты — ранней стадии развития эмбриона: слева — сумчатых (кенгуру) и плацентарных (в центре — мыши, справа — коровы). Стрелкой показан трофобласт. б — Схематическое изображение бластоцисты с трофобластом и внутренней клеточной массой.
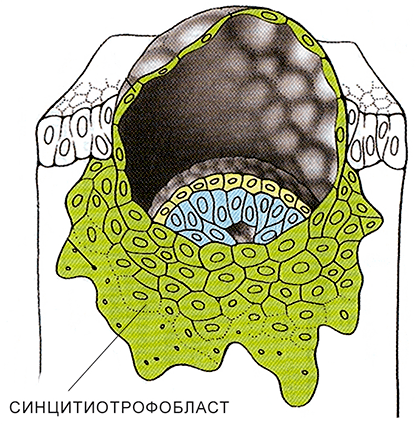
Рисунок 16. Синцитиотрофобласт при внедрении бластоцисты в стенку матки
Опишу кратко механизм, как это происходит: в ходе дальнейшего деления клеток трофобласт расслаивается на внешний и внутренний. Клетки внешнего слоя сливаются, образуя многоядерную структуру, так называемый синцитиотрофобласт (рис. 16) [17]. Он контактирует с децидуальной тканью матки, описанной ранее, прокладывая путь для внедрения эмбриона. В случае гемохориальной (самой инвазивной) плаценты синцитиотрофобласт добивается прямого контакта с материнской кровью, откуда и черпает важные для развития эмбриона молекулы. Помимо этого, синцитиотрофобласт участвует в регулировке иммунного ответа, защите будущего плода от патогенов, секреции гормонов.
Главный герой в процессе слияния клеток трофобласта — белок синцитин, пришедший к млекопитающим вместе с генами древних ретровирусов, проникших в геном млекопитающих в результате инфицирования. У этих вирусов синцитин отвечает за слияние оболочки вируса с оболочками клетки хозяина [28]. Подробно этот момент в эволюции млекопитающих описан в следующей части.
Таким образом, трофобласт — важное приобретение млекопитающих на пути эволюции их плаценты. Отмечу еще раз, что образуется он только у млекопитающих. И у разных млекопитающих свои нюансы этого процесса, что, в свою очередь, влияет на различия в структуре плацент [27].
Часть 2. Важнейшие генетические основы эволюции плаценты у плацентарных
Перед тем, как познакомить вас с генетическими основами эволюции плаценты, предлагаю пробежаться кратко по основам молекулярной биологии, которые помогут понять материал, изложенный в этой части.
Итак, переходим к самому интересному — генетическим основам эволюции плаценты у плацентарных.
Вирусы в геноме плацентарных
Значительная часть геномов живых организмов состоит из нуклеотидных последовательностей вирусных частиц (например, геном человека на 45% [31]), которые однажды инфицировали хозяина, внедрились в его ДНК и остались там. В процессе эволюции такие последовательности (их еще называют мобильными генетическими элементами [32–35]) претерпевали ряд изменений: самокопировались, перескакивали с места на место, теряли небольшие кусочки и/или заимствовали их у других последовательностей и т.д.
Большинство мобильных генетических элементов нейтрально для физиологии хозяина. Какие-то ведут к негативным последствиям (например, ретровирус лейкемии коал). А есть те, чьи функции оказались полезными, обеспечив преимущество своим носителям. Так появились гены упомянутого ранее белка синцитина.
Гены синцитина разных групп млекопитающих
У человека найдены гены syncitin-1 и syncitin-2. Первый вошел в геном приматов около 30 млн лет назад, со вторым судьбоносная встреча произошла раньше — около 45 млн лет назад. Эти гены схожи в своих последовательностях, их белки имеют общую фузогенную активность, то есть способствуют слиянию клеток. Но у гена syncitin-2 есть участок, ответственный за иммуносупрессивную активность белка синцитина. То есть он участвует не только в имплантации эмбриона, но и в подавлении иммунитета матери.
У мышей также найдены два гена: syncitin-A и syncitin-B. Биоинформационный анализ показал, что они отличаются от генов человека, что позволяет говорить об их независимом захвате геномом предков. Syncitin-A и syncitin-B интегрировались в геном грызунов 25 млн лет назад и, несмотря на отличия в последовательностях, выполняют схожие функции: фузогенную и имунносупрессивную [36].
Подобные гены синцитина найдены и у других линий млекопитающих (рис. 17).
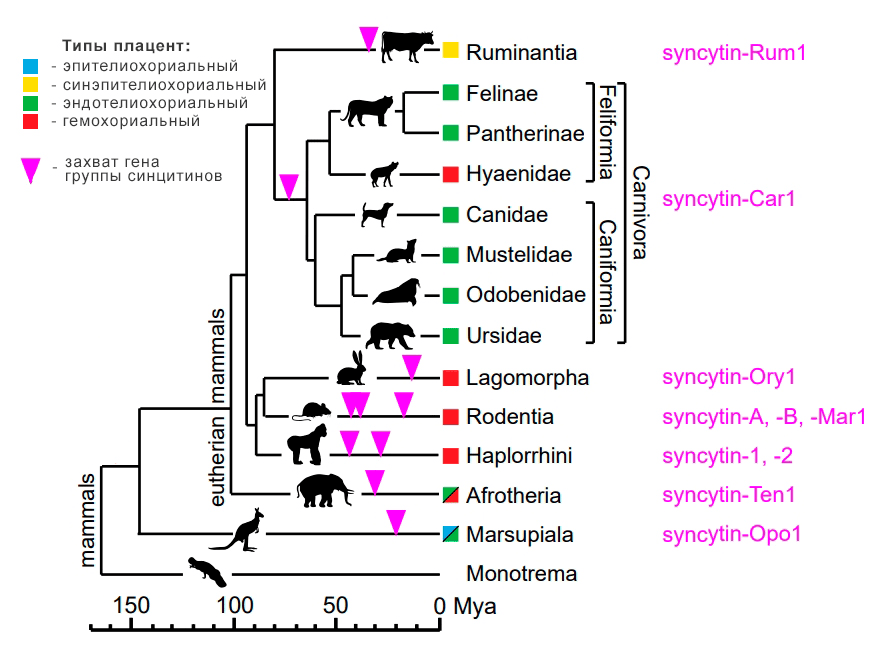
Рисунок 17. Филогения млекопитающих с акцентом на плотоядных. Указана степень инвазивности плаценты для каждой группы животных и случаи захвата генов синцитина в их родословных.
Самый древний из найденных генов этой группы обнаружен у плотоядных — это ген Syncitin-Car1. Еще одна интересная находка была сделана в 2019 году у гиен: найден уникальный ген Hyena-Env2, которого нет у других плотоядных. Его интеграция в геном плотоядных совпадает с отделением линии гиен от остальных кошачьих (около 30 млн лет назад). Было обнаружено, что он не обладает фузогенной активностью, как общий для всех плотоядных ген Syncitin-Car1. В этом контексте отдельного внимания требует следующий факт: гиены, единственные из плотоядных, обладают самым инвазивным типом плаценты — гемохориальным (как и человек). Этот факт связывают с тем самым найденным геном. Но как именно ген Hyena-Env2 способствует такому структурному переходу от эндотелиохориальной плаценты к гемохориальной (как у человека), ученым еще предстоит выяснить [37].
Еще один интересный пример — ген Syncitin-Rum1. Он не встречается ни у одной группы млекопитающих, кроме жвачных. Здесь заслуживает внимания факт, что жвачные — единственная группа с синэпителиохориальной (неинвазивной) плацентой.
Ген INSL4 и его вирусный регулятор
Инвазивность же гемохориальной плаценты некоторых приматов может быть поддержана еще одной древней ретровирусной инфекцией. Например, ген INSL4 (кодирует инсулиноподобный пептид ранней плаценты, участвующий в образовании синцитиотрофобласта) пока обнаружен только у человека и обезьян Нового Света. Специфичная для плаценты активность гена INSL4 контролируется эндогенным вирусным элементом. Ген и его регулирующая область появились 45 млн лет назад и рассматриваются как поддерживающие высокую инвазивность плаценты. Белок гена INSL4 также найден в некоторых раковых клетках для усиления их инвазивности и подвижности [38].
Очевидно, что ретровирусы — мощный двигатель эволюции плаценты. Основные морфологические инновации в плацентах млекопитающих стимулированы их интеграцией в геном. Но стоит отметить и другие механизмы, способствующие этому прогрессу.
«Мама, папа, я — генная семья», или Дупликация генов
Один из способов образования плацентоспецифичных генов — дупликация: удвоение определенного участка нуклеотидной последовательности ДНК. Подобное может возникать в результате ошибки при делении клеток. Появившиеся копии модифицируются, меняя свою последовательность точечно (один нуклеотид) или участками (несколько нуклеотидов). Такие дупликации могут создавать целые семейства генов, и каждый член этого семейства может отвечать за определенную функцию в клетке. Рассмотрим два ярких случая генетических семейств в эволюции плаценты.
Ген INFT
Возвращаясь к группе жвачных, отмечу ген INFT, который кодирует уникальный белок — интерферон-τ. Семейство белков интерферонов (α, β, γ и т.д.) служит для защиты многих живых организмов от нападок врагов (вирусов, бактерий). А у рогатых жвачных, наряду с сохранившимися противомикробными свойствами, интерферон-τ вырабатывается в клетках трофобласта и поддерживает уровень важного гормона беременности — прогестерона [39]. И это его основная функция, приобретенная в процессе молекулярной эволюции. Хотя, например, у приматов и лошадей аналогичную роль на ранних стадиях беременности выполняет другой известный многим гормон — хорионический гонадотропин (ХГЧ у человека).
Сам ген INFT возник 36 млн лет назад, что примерно совпадает с отделением линии жвачных от других парнокопытных. Появился он посредством дупликации предкового гена INFW с последующим перестроением последовательности созданной копии [40]. Описано большое количество вариантов этого гена у разных видов жвачных.
Ген PRL
Еще один яркий пример дупликации — семейство гена пролактина, PRL. У человека всего одна копия этого гена (один экземпляр в геноме), тогда как у коров — 11, а у мышей аж 23. Они многократно дублировались, и в каждой копии накапливались характерные изменения последовательности нуклеотидов. Семейство гена PRL у мыши расположено на 13 хромосоме, и все его члены, кроме самого PRL, экспрессируются в разных типах клеток плаценты, преобладая в клетках трофобласта (рис. 18) [38].
Рисунок 18. Работа семейства гена пролактина в разных типах клеток плаценты мыши. а — Показаны семь различных типов клеток, для каждого из которых найден как минимум один уникальный член семейства гена Prl. Шесть из показанных типов клеток — клетки трофобласта. б — карта семейства гена Prl, расположенного на 13 хромосоме мыши.
Эти гены встречаются только у жвачных и грызунов. Их белки выполняют разнообразные функции при адаптации организма матери к беременности. Но тут эволюция подкинула ученым еще одну загадку: если эти гены встречаются только у грызунов и жвачных, то как эти функции выполняются у других животных? На что ученые выдвинули гипотезу: эти гены выполняют свои функции только в условиях физиологического стресса, например, при кислородном голодании — гипоксии [41]. Такая вот подстраховка, предположительно, возникла у беременных коров и мышей для успешного вынашивания будущего поколения в условиях стресса.
Эволюция регулятора гена децидуализации: вагончик тронулся
Рассмотрим последнюю в этой статье генетическую новинку, повлиявшую на развитие плаценты.
Мы уже обсудили ранее децидуальные клетки, которые образуются в маточных тканях только у плацентарных. Одним из ключевых генов, запускающих реакцию децидуализации, считается FOXO1. Этот ген кодирует белок, регулирующий работу других генов, задействованных в дальнейшем протекании этой реакции [26].
В свою очередь перед геном FOXO1 стоит регулирующий уже его работу промотор. Чтобы не запутаться, представьте такой поезд: промотор гена FOXO1 → ген FOXO1 → регуляторный белок FOXO1 → промоторы других генов децидуализации → гены децидуализации → функциональные белки децидуальных клеток.
Сейчас нам важен только первый вагончик — промотор гена FOXO1. Важным он оказался и для эволюции плаценты. Изменения, затронувшие промотор гена FOXO1, способствовали появлению восприимчивости этой области к сигналам начала децидуализации (от прогестерона и цАМФ): вагончик тронулся, поезд поехал, реакция децидуализации запустилась, децидуальные клетки образовались. А об их значимости в формировании плаценты мы уже говорили.
Важно также понимать, что белок FOXO1 участвует в жизни не только децидуальных клеток, то есть не является специфичным для них. Специфична в этих клетках именно регуляция гена FOXO1. Что же такого необычного произошло в промоторе?
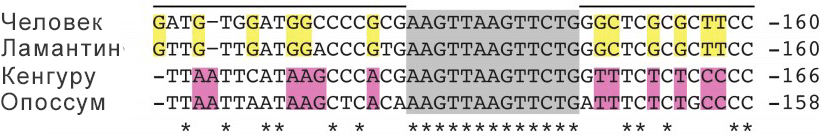
Всё просто: изменилась нуклеотидная последовательность, способная в ходе нужных реакций связываться с нужными белками. Для наглядности изменения важных участков последовательности нуклеотидов изображены на рисунке 19.
Рисунок 19. Изменения нуклеотидных последовательностей в промоторах плацентарных (человек, ламантин) и сумчатых (кенгуру, опоссум). Показаны одинаковые у всех видов нуклеотиды (*) и нуклеотиды, общие только у плацентарных (желтым цветом) и только у сумчатых (фиолетовым цветом).
У сумчатых децидуальные клетки не образуются изначально. А вот упомянутые ранее жвачные с неинвазивной плацентой потеряли способность к децидуализации в процессе эволюции. Это рассматривается как одна из возможных причин, которая привела у них к появлению неинвазивной плаценты [42].
Подводя итоги
Жизнь запрограммирована в нуклеотидной цепочке молекулы ДНК, которая изменяется с течением времени в различных направлениях. Основанные на этом процессе отличия могут обеспечить получившему их виду уникальность и преимущество. Преимущества же позволяют приспособиться к изменяющимся условиям: выжить, пройти естественный отбор, сохранить вид.
Развитие плаценты помогло плацентарным освоиться на нашей планете после исчезновения наземных видов динозавров и способствовало началу эры млекопитающих. Ретровирусные инфекции, дупликации генов, изменения нуклеотидной последовательности регуляторных участков ДНК — одни из важных генетических механизмов эволюции плаценты.
Ученые в этой области изучают гораздо больший список генов и их регуляторов, чем я охватила в своей работе. И благодаря этим важнейшим генетическим исследованиям с каждым годом раскрывается всё больше тайн, связанных с беременностью, развитием и рождением. Немаловажно, что многие открытия приобретают практическую значимость в репродукции человека и развитии биотехнологий, которые позволяет решать насущные проблемы бесплодия и прерывающейся беременности.
Кто знает, сколько еще неизведанных путей в лабиринте, созданном эволюцией и называемом Древом жизни! А сколько из них мы сможем пройти, изучить, понять? Осилит ли Человек эту задачу, или пути эволюции неисповедимы?
- Daniel G. Blackburn. (2015). Evolution of vertebrate viviparity and specializations for fetal nutrition: A quantitative and qualitative analysis. Journal of Morphology. 276, 961-990;
- Oliver W. Griffith, Günter P. Wagner. (2017). The placenta as a model for understanding the origin and evolution of vertebrate organs. Nat Ecol Evol. 1;
- РНК у истоков жизни?;
- РНК: начало (мир РНК);
- К вопросу о происхождении жизни;
- John A. Long, Kate Trinajstic, Gavin C. Young, Tim Senden. (2008). Live birth in the Devonian period. Nature. 453, 650-652;
- Gilmore R.G., Putz O., Dodrill J.W. Oophagy, intrauterine cannibalism and reproductive strategy in lamnoid sharks. In: Reproductive Biology and Phylogeny of Chondrichthyes: Sharks, Batoids and Chimaeras / ed. by Hamlett W.C. Enfield, NH: Science Publishers, 2005. — P. 435–462;
- H.W. Mossman. (1991). Comparative morphogenesis of the fetal membranes and accessory uterine structures. Placenta. 12, 1-5;
- Hartmut Greven. (2011). Maternal Adaptations to Reproductive Modes in Amphibians. Hormones and Reproduction of Vertebrates. 117-141;
- Oliver W. Griffith, Arun R. Chavan, Stella Protopapas, Jamie Maziarz, Roberto Romero, Gunter P. Wagner. (2017). Embryo implantation evolved from an ancestral inflammatory attachment reaction. Proc Natl Acad Sci USA. 114, E6566-E6575;
- M. A. O’Leary, J. I. Bloch, J. J. Flynn, T. J. Gaudin, A. Giallombardo, et. al.. (2013). The Placental Mammal Ancestor and the Post-K-Pg Radiation of Placentals. Science. 339, 662-667;
- M. S. Springer, R. W. Meredith, E. C. Teeling, W. J. Murphy. (2013). Technical Comment on «The Placental Mammal Ancestor and the Post-K-Pg Radiation of Placentals». Science. 341, 613-613;
- Thomas J. D. Halliday, Paul Upchurch, Anjali Goswami. (2017). Resolving the relationships of Paleocene placental mammals. Biol Rev. 92, 521-550;
- R Michael Roberts, Jonathan A Green, Laura C Schulz. (2016). The evolution of the placenta. Reproduction. 152, R179-R189;
- J.C Cross, D Baczyk, N Dobric, M Hemberger, M Hughes, et. al.. (2003). Genes, Development and Evolution of the Placenta. Placenta. 24, 123-130;
- A.C. Enders. (2009). Reasons for Diversity of Placental Structure. Placenta. 30, 15-18;
- Paul Bischof, Irmgard Irminger-Finger. (2005). The human cytotrophoblastic cell, a mononuclear chameleon. The International Journal of Biochemistry & Cell Biology. 37, 1-16;
- D. E. Wildman, C. Chen, O. Erez, L. I. Grossman, M. Goodman, R. Romero. (2006). Evolution of the mammalian placenta revealed by phylogenetic analysis. Proceedings of the National Academy of Sciences. 103, 3203-3208;
- M.G. Elliot, B.J. Crespi. (2009). Phylogenetic Evidence for Early Hemochorial Placentation in Eutheria. Placenta. 30, 949-967;
- Nowak R.M. Walker`s mammals of the world. Johns Hopkins University Press, 1999. — 2015 p.;
- Michael J. Novacek, Guillermo W. Rougier, John R. Wible, Malcolm C. McKenna, Demberelyin Dashzeveg, Inés Horovitz. (1997). Epipubic bones in eutherian mammals from the Late Cretaceous of Mongolia. Nature. 389, 483-486;
- Arun Rajendra Chavan, Oliver William Griffith, Günter Paul Wagner. (2017). The inflammation paradox in the evolution of mammalian pregnancy: turning a foe into a friend. Current Opinion in Genetics & Development. 47, 24-32;
- Arun Rajendra Chavan, Bhart-Anjan S. Bhullar, Günter P. Wagner. (2016). What was the ancestral function of decidual stromal cells? A model for the evolution of eutherian pregnancy. Placenta. 40, 40-51;
- Памфамиров Ю.К. и Самойленко А.В. (2017). Врастание плаценты. Стратегия лечения. Реалии. Ближайшие перспективы. «Современные инновации». 3, 33–35;
- Ведищев С.И., Прокопов А.Ю., Жабина У.В., Османов Э.М. (2013). Современные представления о причинах невынашивания беременности. «Вестник российских университетов. Математика». 18, 1309–1312;
- Yeonwoo Park, Mauris C. Nnamani, Jamie Maziarz, Günter P. Wagner. (2016). Cis-Regulatory Evolution of Forkhead Box O1 (FOXO1), a Terminal Selector Gene for Decidual Stromal Cell Identity. Mol Biol Evol. 33, 3161-3169;
- Stephen R. Frankenberg, Flavia R.O. de Barros, Janet Rossant, Marilyn B. Renfree. (2016). The mammalian blastocyst. WIREs Dev Biol. 5, 210-232;
- Christian Lavialle, Guillaume Cornelis, Anne Dupressoir, Cécile Esnault, Odile Heidmann, et. al.. (2013). Paleovirology of ‘
syncytins
’, retroviral
env
genes exapted for a role in placentation. Phil. Trans. R. Soc. B. 368, 20120507; - Daniel J. Richter, Nicole King. (2013). The Genomic and Cellular Foundations of Animal Origins. Annu. Rev. Genet.. 47, 509-537;
- Douglas H. Erwin. (2009). Early origin of the bilaterian developmental toolkit. Phil. Trans. R. Soc. B. 364, 2253-2261;
- Eric S. Lander, Lauren M. Linton, Bruce Birren, Chad Nusbaum, Michael C. Zody, et. al.. (2001). Initial sequencing and analysis of the human genome. Nature. 409, 860-921;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Как составлялся геном эукариот: эндосимбиоз VS. непрерывный горизонтальный перенос;
- Тайны «молекулярных паразитов», или Как путешествовать по геному;
- Разнообразия много не бывает: чем занимаются мобильные элементы генома в мозге;
- A. Dupressoir, G. Marceau, C. Vernochet, L. Benit, C. Kanellopoulos, et. al.. (2005). Syncytin-A and syncytin-B, two fusogenic placenta-specific murine envelope genes of retroviral origin conserved in Muridae. Proceedings of the National Academy of Sciences. 102, 725-730;
- Mathis Funk, Guillaume Cornelis, Cécile Vernochet, Odile Heidmann, Anne Dupressoir, et. al.. (2018). Capture of a Hyena-Specific Retroviral Envelope Gene with Placental Expression Associated in Evolution with the Unique Emergence among Carnivorans of Hemochorial Placentation in Hyaenidae. J Virol. 93;
- Saara M. Rawn, James C. Cross. (2008). The Evolution, Regulation, and Function of Placenta-Specific Genes. Annu. Rev. Cell Dev. Biol.. 24, 159-181;
- Angela M. Walker, Koji Kimura, R. Michael Roberts. (2009). Expression of bovine interferon-tau variants according to sex and age of conceptuses. Theriogenology. 72, 44-53;
- Alan D Ealy, Lydia K Wooldridge. (2017). The evolution of interferon-tau. Reproduction. 154, F1-F10;
- Pengli Bu, Sheikh M. Khorshed Alam, Pramod Dhakal, Jay L. Vivian, Michael J. Soares. (2016). A Prolactin Family Paralog Regulates Placental Adaptations to a Physiological Stressor1. Biology of Reproduction. 94;
- Anthony M. Carter. (2018). Recent advances in understanding evolution of the placenta: insights from transcriptomics. F1000Res. 7, 89.
Инфракласс: Плацента́рные (Placentalia)
| Научная | классификация |
| Без ранга: | Вторичноротые (Deuterostomia) |
| Тип: | Хордовые (Chordata) |
| Подтип: | Позвоночные (Vertebrata) |
| Инфратип: |
Челюстноротые (Ghathostomata) |
| Надкласс: |
Четвероногие (Tetrapoda) |
| Класс: |
Млекопитающие (Mammalia) |
| Подкласс: |
Звери (Teria) |
| Инфракласс: | Плацентарные (Eutheria) |
| Надотряд: |
Эуархонтогли́ры (Euarchontoglires) Лавразиоте́рии (Laurasiatheria) Неполнозу́бые (Xenarthra) Афроте́рии (Afrotheria) |
1. Общие сведения о Плацентарных животных


2. Происхождение и эволюция Плацентарных
Предположительно первые Плацентарные появились 172 — 160 млн. лет назад. Старейшие представители данного инфракласса были найдены на территории Китая, так на сегодня древнейшим из известных плацентарных является юромайя похожая на землеройку и обитавшая в Юрском периоде около 160 млн. лет назад. Весившая всего 15 г, она, скорее всего, хорошо лазила по деревьям и питалась насекомыми. [1]
К концу мелового периода – палеоцена, уже существовало большинство отрядов Плацентарных, а в последующие эпохи происходило их разделение на семейства и более мелкие таксономические группы.

Точные эволюционные отношения среди надотрядов Плацентарных еще остаются частично спорными. Предлагается, что самый старый раскол произошел между Afrotheria и остальными группами примерно 105 млн. лет назад, когда Африканский континент отделился от других. Генетический анализ и анализ окаменелостей показывают, что группа Xenarthra развилась в Южной Америке и отделилась от двух других групп позже. Таким образом, Laurasiatheria и Euarchontoglires более сроднившиеся, чем другие надотряды и иногда группируются вместе в магнотряд Boreoeutheria [3].
| Placentalia |
|
||||||||||||
3. Классификация Плацентарных

Афроте́рии (лат. Afrotheria) (слоны, трубкозубы, даманы, дюгони), Неполнозу́бые (лат. Xenarthra) (броненосцы, ленивцы, мкравьеды), Эуархонтогли́ры (лат. Euarchontoglires) (грызуны, шерстокрылы, приматы) и Лавразиоте́рии (лат. Laurasiatheria) (насекомоядные, рукокрылые, хищные, непарнокопытные, китообразные). Кроме того сюда входит пятый надотряд вымерших Южноамериканских копытных (Meridiungulata) [4].
Представители инфракласса Плацнтарных включают в себя около 5149 видов, объединенных в 20 отрядов, примерно 135 семейств и 1150 родов.
Надцарство: Эукариоты —Царство: Животные — Подцарство: Эуметазои — Раздел: Билатеральные — Надтип: Вторичноротые — Тип: Хордовые — Подтип: Позвоночные — Инфратип: Челюстноротые — Надкласс: Четвероногие — Класс: Млекопитающие — Подкласс: Звери —
— Инфракласс: Плацентарные:
| / | | | | | ||
| Эуархонтогли́ры | Лавразиоте́рии | Неполнозу́бые | Афроте́рии | — Надотряды |
| Источники: | 1. | Мир дикой природы |
| 2. | Мир дикой природы | |
| 3. | Циклопедия | |
| 4. | Википедия |
- Research article
- Open Access
- Published: 03 July 2018
BMC Evolutionary Biology
volume 18, Article number: 104 (2018)
Cite this article
-
5302 Accesses
-
25 Citations
-
107 Altmetric
-
Metrics details
Abstract
Background
Recent molecular dating estimates for placental mammals echo fossil inferences for an explosive interordinal diversification, but typically place this event some 10–20 million years earlier than the Paleocene fossils, among apparently more “primitive” mammal faunas.
Results
However, current models of molecular evolution do not adequately account for parallel rate changes, and result in dramatic divergence underestimates for large, long-lived mammals such as whales and hominids. Calibrating among these taxa shifts the rate model errors deeper in the tree, inflating interordinal divergence estimates. We employ simulations based on empirical rate variation, which show that this “error-shift inflation” can explain previous molecular dating overestimates relative to fossil inferences. Molecular dating accuracy is substantially improved in the simulations by focusing on calibrations for taxa that retain plesiomorphic life-history characteristics. Applying this strategy to the empirical data favours the soft explosive model of placental evolution, in line with traditional palaeontological interpretations – a few Cretaceous placental lineages give rise to a rapid interordinal diversification following the 66 Ma Cretaceous-Paleogene boundary mass extinction.
Conclusions
Our soft explosive model for the diversification of placental mammals brings into agreement previously incongruous molecular, fossil, and ancestral life history estimates, and closely aligns with a growing consensus for a similar model for bird evolution. We show that recent criticism of the soft explosive model relies on ignoring both experimental controls and statistical confidence, as well as misrepresentation, and inconsistent interpretations of morphological phylogeny. More generally, we suggest that the evolutionary properties of adaptive radiations may leave current molecular dating methods susceptible to overestimating the timing of major diversification events.
Background
Molecular and palaeontological analyses of placental mammals both identify an interordinal diversification spike, in which the stem lineages of nearly all 18 modern orders (e.g. primates, rodents) originated over a period of just a few million years (Ma). However, most molecular dating estimates (e.g. [1,2,3]) for this diversification are 10–20 Ma older than observed in the fossil record [4, 5]. The extraordinary fossil record surge for eutherians (crown placentals and their extinct stem relatives) follows the 66 Ma Cretaceous-Paleogene boundary (KPg) mass extinction event (Fig. 1). This fossil record diversification also manifests as a taxonomic phase change, with eutherians as a percentage of new mammal species appearances increasing from an average of 27% during the Campanian and Maastrichtian, to 84% during the Paleocene.
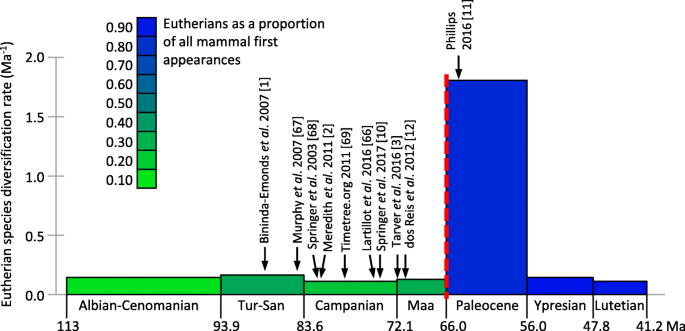
Eutherian fossil record species diversification rate. Data points are calculated as new appearances/Ma (scaled by species richness in the previous time bin, a proxy for starting species richness). Barremian-Aptian provides the previous time bin for Albian-Cenomanian. The green-blue colour shading indicates the proportion of eutherians among mammal first appearances for each time bin. Referenced arrows indicate molecular dating estimates for the temporal midpoint of the placental interordinal diversification, including for Laurasiatheria, Euarchontoglires and Afrotheria (See Additional file 2: Table S2). The KPg boundary is shown as red dashes. Tur-San, Turonian to Santonian; Maa, Maastrichtian [1,2,3], [10,11,12] [66,67,68,69]
Full size image
If the older molecular dates for the interordinal diversification are instead correct, then this most profound event in placental history leaves no discernible trace in the fossil record (Fig. 1). This is especially perplexing, because ancestral area reconstruction [6] places this proposed ~ 75–85 Ma molecular radiation (including stem members of all 11 Northern Hemisphere orders) right alongside the best Late Cretaceous fossil faunas in Eurasia and North America. It is similarly incongruous that during the diversity surge in the placental fossil record following the KPg mass extinction [7, 8] those same molecular timetrees instead imply stable or even declining diversification [2, 9]. Springer et al.’s [10] new tree does place several additional primate and rodent divergences close to the KPg relative to [2], but this may be an artefact of adding maximum bounds at the KPg for these clades to bump up against.
Phillips [11] recently presented evidence for two methodological contributors to molecular dates overestimating early divergences among placentals: (1) Molecular clocks over-smooth parallel decelerations in evolutionary rates among large, long-lived mammals. This results in several-fold divergence underestimates in groups such as whales and seacows, for which calibration to correct these clade ages simply transfers the underlying rate error stemwards, and inflates divergence estimates deeper in the tree. (2) Such “error-shift inflation” is further facilitated by asymmetry in calibration priors between minimum bounds that are highly speculative, and maximum bounds that are too conservative to buffer against rate misspecification or erroneous minimum bounds at other nodes.
Phillips [11] sought to ameliorate error-shift inflation in two steps. The first reduced the impact of oversmoothed, parallel rate decelerations on dates deeper in the tree, by employing dos Reis et al.’s [12] calibration scheme – which includes fewer constraints among large, long-lived taxa than does Meredith et al.’s [2] scheme. The second step reduced asymmetry in fossil calibration priors, by revising overly conservative maximum bounds in line with best practices [13], so as to enhance the capacity of the calibration scheme to buffer against rate errors. The revised calibration scheme was then used to reanalyse Meredith et al.’s [2] 26-locus dataset for 169 taxa, and resulted in molecular dates that closely matched long-held fossil record expectations [14,15,16]. We refer to this as the “soft explosive” model of placental evolution; a few Cretaceous placental lineages seed the massive interordinal diversification spike that follows the KPg extinction event. In contrast, the “hard explosive” model [4, 5] places both the placental origin and initial radiation near or after the KPg.
Although the soft explosive model brings agreement between molecular and fossil inference of placental evolution, it has recently been criticized by Springer et al. [10] on two grounds. The first criticism is that Phillips [11] erroneously dragged divergences younger by “eliminating calibrations in large-bodied/long lifespan clades” without deleting those taxa. This claim is false. Phillips [11] maintained each of dos Reis et al.’s [12] calibrations that were placed in large-bodied/long lifespan clades. Springer et al.’s [10] argument was also based on an analysis in which they deleted large, long-lived taxa, and found that most supraordinal divergences increased by 8–10 Ma relative to Phillips [11]. However, Springer et al. [10] failed to control for calibration, and it is not their taxon deletion, but their inclusion of poorly supported calibrations that drives the divergence estimates older (as discussed below; also see Additional file 1). Indeed, when we repeat their taxon deletion, but maintain the original calibration scheme of Phillips [11], the divergence estimates again support the soft explosive model (dR32 analysis, Table 1C).
Full size table
Springer et al.’s [10] second criticism of the soft explosive model was that many divergences post-date the earliest fossil evidence for the clade, thus implying the existence of fossil “zombie” lineages. We will show that this criticism is based on misrepresentation, false precision in their interpretation of molecular dates, and overconfidence in poorly resolved fossil relationships.
One point of agreement in the debate over the timescale of placental evolution is that calibrating among large, long-lived taxa results in older age estimates for the root and interordinal divergences [2, 10, 11]. Nevertheless, attempting to understand and quantify the contribution from error-shift inflation may be confounded by variation in calibration precision (how closely fossil calibrations match true divergences) – which may differ between the deleted large, long-lived calibrations and the remaining calibrations. Here we use simulations based on empirical estimates of molecular rate variation among placentals to control for calibration accuracy and precision, and to better understand the influence of error-shift inflation.
Considered together, our simulation study and new molecular dates based on revised fossil calibrations for the datasets of Meredith et al. [2] and Liu et al. [17] provide strong support for the soft explosive model of placental diversification. Moreover, previous, older molecular dates are explained as artefacts of errors in both calibration and modelling rate variation across the tree. In turn, the younger KPg diversification allows us to revise Romiguier et al.’s [18] surprising molecular inference of early placental life history traits. More generally, there is a wider pattern of conflict between molecular dates and fossil evidence for the timing of major diversifications, such as for birds [19, 20], flowering plants [21,22,23] and the Cambrian explosion [24]. We discuss the possibility that major adaptive radiations could be particularly susceptible to error-shift inflation, resulting in molecular divergence overestimates.
Results and discussion
Simulated rate deceleration among large, long-lived taxa mimics observed molecular dating errors
To control for calibration and isolate the behaviour of error-shift inflation, we simulated molecular data on a phylogeny of given age (Fig. 2a) that is simplified from the proposed mammalian timetree of Phillips (Figure five in [11]). We simulate “placentals” originating at 80 Ma, then splitting into two 66 Ma superorders (e.g. “Laurasiatheria” and “Afrotheria”), which each give rise to two 33 Ma calibrated clades. In the first set of simulations the branch rates are randomly drawn from a lognormal distribution modelled on inferred rates from Phillips [11] for small to mid-sized mammals (< 30 kg adult body mass, < 40 years maximum longevity). Relaxed molecular clock dating in MCMCtree [25, 26] accurately reconstructs all node heights under this simple distribution of rates across the tree (Fig. 2c-e, light grey bars). However, when we simulate a parallel rate deceleration reminiscent of whales or seacows for just one of the 33 Ma calibrated nodes in each superorder, the MCMCtree reconstructions reveal extreme error-shift inflation. Average estimates for the 66 Ma superorders were inflated to 80.5 Ma, and the 80 Ma placental root was inflated to 107.9 Ma. In each case the 95% CIs are fully older than the simulated dates. These inflated divergences closely mimic recent molecular dates for placental mammals.
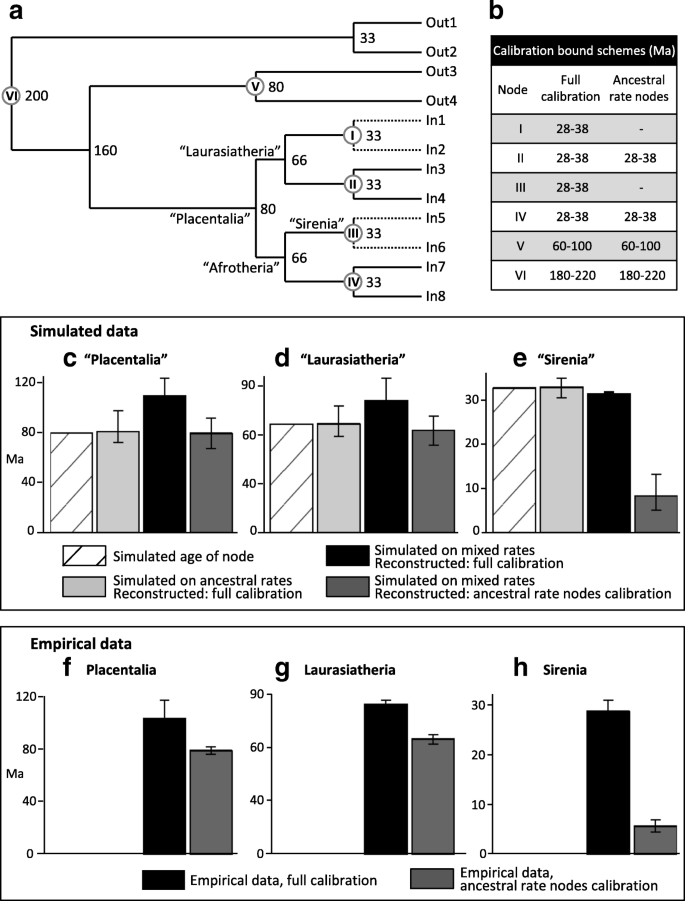
Simulating error-shift inflation of deep placental divergences, and amelioration by excluding calibrations among large, long-lived clades. a. Dated tree on which 20,000 bp DNA sequences were simulated under two rate schemes, “ancestral rates” with all branch rates drawn from a single lognormal distribution (see Methods) and “mixed rates” with the rate drawn from that same distribution, except divided by 5 for the daughter lineages of nodes I and III. b. Soft bound calibrations on nodes I-VI under alternative MCMCtree reconstructions. Date estimates and 95% CIs for simulated clades c “Placentalia” d “Laurasiatheria” and e “Sirenia” are shown for the “ancestral rates” simulation (light grey), and for the “mixed rates” simulation with either full calibration (black) or calibration only on ancestral rates clades (dark grey). Corresponding date estimates from Phillips ([11], Fig. 4c,d) on the empirical data are shown for f Placentalia, g Laurasiatheria and h Sirenia, with full calibration (black) and largely focusing on ancestral rates clades (dark grey)
Full size image
Our simulations also reproduce the empirical pattern of extreme dating underestimation for large, long-lived clades for when they are not calibrated. In particular, the low rate clades simulated as 33 Ma are reconstructed by MCMCtree with a mean age of 8.5 Ma, almost as extreme as the empirical pattern for seacow origins falling from ~ 28 Ma to 5.7 Ma when uncalibrated (Fig. 2e,h). Importantly though, excluding calibrations among the low rate (large, long-lived) clades allows accurate inference of divergence dates deeper in the tree, returning reconstructions close to the simulated ages (Fig. 2c,d “mixed rates ancestral calibrations” – dark grey bars). It is remarkable how closely the pattern of uncalibrating large, long-lived taxa to overcome the simulated error-shift inflation (Fig. 2c-e) mirrors the empirical pattern for placental mammals (Fig. 2f-h). Thus, our simulations, which are based on empirical rate variation, show that error-shift inflation associated with parallel rate deceleration among large, long-lived placentals can explain the proposed overestimation of interordinal divergences among molecular dating analyses.
Conjuring up “zombie” lineages
Lane et al. [27] coined the term “zombie lineage” for the extension of a taxon’s survival beyond their last fossil appearance. Springer et al. [10] re-purposed the term for molecular divergences that are younger than minimum ages implied by fossil records, and claim that Phillips’ [11] “preferred timetree” includes 61 (of 136) internal placental nodes that are younger than first fossil appearances, thus resulting in “zombie” lineages. Springer et al.’s [10] claim is based on a series of misrepresentations, which are best appreciated by first understanding how Phillips’ [11] timetree was constructed. Phillips [11] recognised that calibrating large, long-lived taxa in the tree of more plesiomorphic mammals erroneously inflates interordinal divergences (also shown here with simulations, Fig. 2c,d “full calibration” – black bars), whereas not calibrating among these taxa underestimates their own family-level divergences (Fig. 2e “mixed rates ancestral calibrations” – dark grey bar). Phillips [11] addressed this challenge in two steps. The first step inferred divergences with dos Reis et al.’s [12] calibrations, most of which are set among taxa with plesiomorphic life-history (tree 1, Fig. 4d in [11]). The final timetree (tree 2, Figure five in [11]) was then inferred with more calibrations added among large, long-lived taxa, but with maximum bounds on several superordinal clades based on broad agreement between tree 1 and fossil records for major diversification following the KPg (and also noting that multi-lineage diversifications should provide more robust markers in the fossil record than individual nodes).
Springer et al.’s [10] misrepresentation begins by overlooking Phillips’ [11] discussion of uncalibrated divergences among large, long-lived taxa being underestimated in tree 1, and falsely claiming tree 1 to be Phillips’ [11] “preferred tree”. They then ignore the final timetree with those taxa calibrated (tree 2), which Phillips [11] used for final inference of molecular rates, and instead, Springer et al. [10] set up the tree 1 dates as a straw man for comparison with fossil dates.
A careful examination of the (actually) 62 nodes that Springer et al. [10] tabled as postdating proposed fossil dates reveals that 40 involve clades of large/long-lived taxa. These underestimates follow directly from the aims for tree 1, which were to reveal the extent of date underestimation among large, long-lived clades and to isolate the interordinal nodes from error-shift inflation that would result from those large, long-lived clades being calibrated (as our simulation study confirms, Fig. 2). Springer et al. [10] perhaps agree, and deleted all 40 of those large, long-lived clades for their analysis.
The more concerning claim that Phillips [11] underestimated the age of 22 clades that retain apparently more plesiomorphic life history traits is illusory, created from false precision. Springer et al. [10] exaggerate disagreement here by treating those molecular dates as errorless, and by ignoring uncertainty in the phylogenetic attribution of reference fossils for minimum bounds. If instead we undertake the usual practices of basing fossil minimum dates on phylogenetically well-supported fossils, and considering Bayesian molecular divergences as 95% credible intervals (CIs), then the discrepancy vanishes for 20 of the 22 clades (Additional file 1). Moreover, Phillips’ [11] final molecular dates (tree 2) place the 95% CIs for the two remaining clades, Musteloidea (28.5–30.7 Ma) and Feliformia (30.3–35.3 Ma) entirely older than their respectively proposed fossil minima of 24.8 Ma and 28.1 Ma. The tree 2 analysis was primarily designed to test rate variation hypotheses, and still retains some dubious fossil calibrations from Meredith et al. [2]. But it is notable that our primary dating estimates in this study are also consistent with both of these proposed fossil minima (Additional file 2, 122-taxon dR40 trees). Thus, Springer et al.’s [10] claim of “zombie” lineages among smaller, shorter lived taxa is unfounded.
Dating the evolution of placental mammals
We have updated our calibration set to allow for eight additional well-supported calibrations (Additional file 3) that were not employed by dos Reis et al. [12], but include several that Springer et al.’s [10] list of “zombie” lineages implied would increase our divergence estimates. This lifts the number of calibration priors to 40 for the same 122 taxa with apparently plesiomorphic life histories that were employed by Springer et al. [10]. The resulting MCMCtree timetree (dR40, see Table 1D) provides very similar divergence estimates to our previous calibration schemes (Table 1A,C). The most profound diversification in placental mammal history again falls across or closely follows the KPg boundary (see Fig. 3a), including for the basal radiations of all three major superorders (Laurasiatheria, Afrotheria and Euarchontoglires).
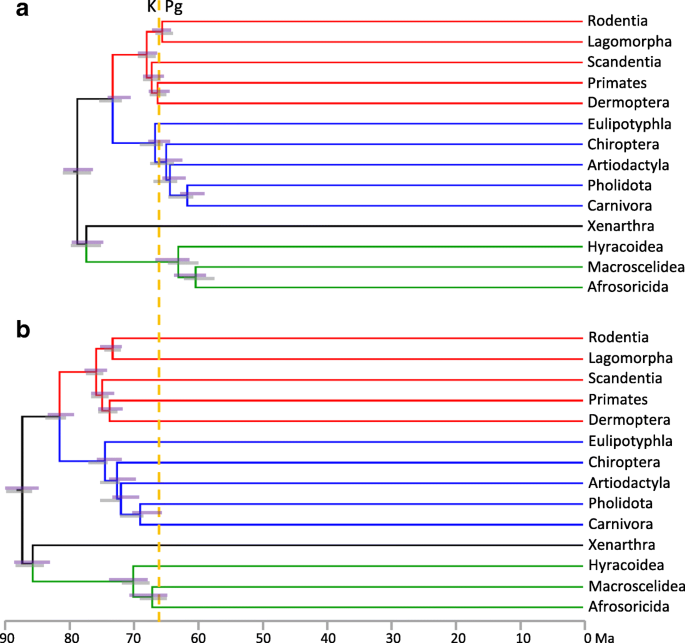
Placental mammal ordinal-level timetrees on the 122-taxon dataset for which large, long-lived taxa are excluded. Node heights are averaged over MCMCtree independent and autocorrelated rates analyses, with 95% CIs shown for analyses under independent rates (purple bars) and autocorrelated rates (grey bars). a. using our dR40 calibration set. b. Adding additional poorly-vetted calibrations for Lorisiformes, Lagomorpha, Emballonuroidea and Erinaceidae-Soricidae, and with maximum bounds for basal Primates, Rodentia and Chiroptera increased, following Springer et al. [10]. Substituting in these “dR40Springer” calibrations inflates the midpoint for the primary placental interordinal diversification from 64.5 Ma to 72.2 Ma
Full size image
To isolate the source of the differences between our dates and Springer et al.’s [10] dates we identified poorly-vetted reference fossils that they used to define seven placental calibration minima that are older than our dR40 molecular estimates (Table 2). In several cases the temporal difference is so minor (1.5–2.8 Ma) as to have little impact deeper in the tree. However, four of Springer et al.’s [10] fossil minima are strikingly older than our molecular estimates, and reveal breathtaking inconsistency in how these authors treat morphological phylogenetic evidence. For example, Springer et al. [10, 28, 29] express valid cautions, and are highly critical of morphological phylogeny, even for well-sampled modern or Mesozoic eutherians that are analysed within objective, statistical frameworks. Yet, when it comes to calibration, Springer et al. [10] accept reference fossils based on highly fragmentary material, unverified by any formal phylogenetic analyses (matrix-based or otherwise) or that are contradicted by such analyses (see Additional file 1) – then employ these fossils as minimum bounds with 97.5% or indeed, preferentially with 100% prior probability.
Full size table
The four poorly-vetted fossils that substantially conflict with our molecular dates are:
-
(1)
The ~ 38 Ma Saharagalago (calibrating Lorisiformes) is known from just two molars. Phillips (Figure two in [11]) showed this calibration to be an extreme outlier for apparent dating error (or rate distortion). The most likely explanation is that Saharagalago (and Karanisia from the same locality) falls outside Lorisiformes, as two recent phylogenetic analyses found [30, 31].
-
(2)
The ~ 53 Ma ‘Vastan’ ankle bones (calibrating Lagomorpha) were found by Rose et al. [32] to group with Oryctolagus to the exclusion of other rabbits and hares. If true, these ankle bones would implausibly pre-date molecular dating expectations for the Oryctolagus—Sylvilagus divergence by ~ 5-fold [33]. However, Rose et al. [32] did not consider sampling error and noted that the morphological signal may be confounded by functional similarities. Zhang et al.’s [34] μCT scans have since shown that a key character, the calcaneal canal, is also present in stem lagomorphs. Our re-analysis of Rose et al. [32] excluding the calcaneal canal character places the Vastan ankle bones outside crown lagomorphs, although their affinities remain statistically unresolved (Additional file 1: Figure S1).
-
(3)
The ~ 47 Ma bat, Tachypteron (calibrating Emballonuroidea) was assigned by Storch et al. [35] only on the basis of similarities, and within a framework that considered emballonurids as sister to rhinolophoids. These two groups are now known to fall on opposite sides of the chiropteran tree [36], and some other Eocene European bats previously assigned to Emballonuridae and Rhinolophoidea have since been placed in a new family of uncertain affinities [37]. Tachypteron was not considered in that study. Ravel et al.’s [38] cladistic analysis of Tachypteron and Vespertiliavus included only emballonuroids among crown bats. Hence, the placement of Tachypteron requires confirmation, especially analysis of cranial and post-cranial material.
-
(4)
The ~ 62 Ma Adunator (calibrating Erinaceidae-Soricidae) has been considered an erinaceomorph (e.g. [39]). However, this assignment is precarious; other work questions whether Adunator even falls within Lipotyphla. Novacek et al. [40] stated that Adunator is in “limbo between primitive insectivorans and primitive condylarths”, while [41] instead place Adunator with elephant shrews. Moreover, the calibration reference (A. ladae) has not been tested in formal phylogenetic analyses, and has recently been placed a resurrected genus (Mckennatherium) with even less certain affinities [42].
The potential for interordinal divergences to be inflated by poorly-justified calibration minimum bounds (or by rate model errors) is exacerbated by overly conservative maximum bounds. Maximum bounds should cover the time back until relatively well sampled fossil assemblages in potential geographic regions of origin that contain no putative crown group members, but contain stem members or ecological equivalents [13, 43] . These conditions are met for Chiroptera in the Thanetian (base = 59.2 Ma) [44] and for both Primates and Rodentia in the Selandian (base = 61.6 Ma) [11]. Springer et al. [10] extend each of these maximum bounds by one or more additional geological stages, based on arbitrary phylogenetic bracketing from [45] or unspecified uncertainty in the case of bats, from [46].
It is now apparent that the few most problematic minimum and maximum calibration bounds listed above are the main drivers for Springer et al. [10] pushing the primary diversification of placental mammals back into the Cretaceous. This can be shown by starting with our dR40 analysis of the 122-taxon dataset, and then substituting in Springer et al.’s [10] minimum bounds for Lorisiformes, Lagomorpha, Emballonuroidea and Erinaceidae-Soricidae, and their maximum bounds for basal rodents, primates and bats. With this dR40Springer calibration set, the midpoint of the primary placental interordinal diversification shifts from 64.5 Ma, back to 72.2 Ma (Fig. 3), closely approaching Springer et al.’s [10] 74.1 Ma diversification midpoint. In contrast, our basal Paleocene estimate is in phase with the primary diversification in the fossil record (Fig. 1) and with a new generation of morphological/total evidence dating [47, 48].
Applying Springer et al.’s [10] more conservative rodent, primate and bat maximum bounds alone explains very little of the date increases shown in Fig. 3b. Substituting these older maxima into our dR40 analyses lifts the midpoint of the primary placental interordinal diversification by only 0.8 Ma, to 65.3 Ma (Additional file 2). It is only with the further inclusion of the poorly-vetted lorisiform, lagomorph, emballonuroid and erinaceid-soricid minimum bounds that the interordinal divergences are pushed far older (Fig. 3b).
We compared the specified soft bounds, joint marginal priors and posterior estimates for the above-noted key nodes (Fig. 4). The posterior 95% CIs fit better with our preferred dR40 calibrations (above: orange marginal prior, purple/brown posterior CIs) than with the dR40Springer calibrations (below: grey marginal prior, green/black posterior CIs). For all of these key calibrations our dR40 posterior CIs fell within or largely overlap the joint marginal prior. Whereas, with Springer et al.’s [10] calibrations, the posterior CI for either the independent or autocorrelated rates analysis falls fully outside both the specifed and marginal priors for Primates, Rodentia, Lagomorpha, Lorisiformes, and almost for Emballonuroidea. The lorisiform mismatch is extreme, being far younger than Springer et al.’s [10] Saharagalago reference fossil, which in turn, induces an anomalous 4.69-fold rate deceleration for this clade (see Additional file 2).
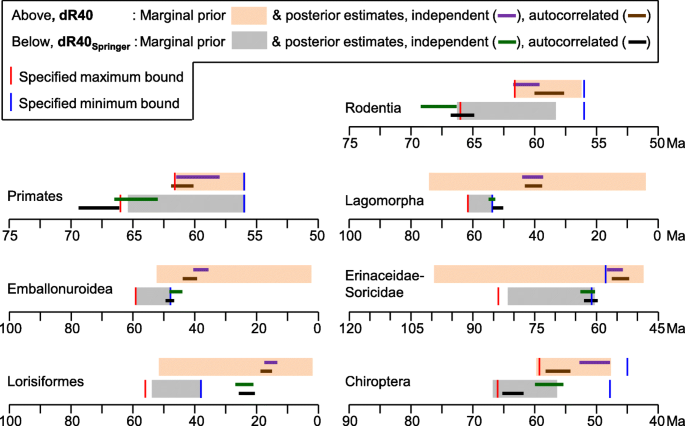
Comparison of the dR40 and dR40Springer calibration bounds, joint marginal priors, and posterior divergence estimates for seven key clades. For each clade the calibration bounds and 95% CIs for marginal priors and posterior estimates are shown (above) for our preferred dR40 calibration set, and (below) for the dR40Springer calibration set with calibration bounds substituted in from Springer et al. [10]. Posterior estimates are shown separately for the autocorrelated and independent rates models, however, the marginal priors under these two rates models are effectively the same, and here for clarity we average over the slight, primarily stochastic differences between them. (marginal priors and posterior estimates are provided in Additional file 2). Erinaceidae-Soricidae is further discussed in Additional file 1 (“Incorrect or poorly supported fossil placements”, 7)
Full size image
One recent genome-scale inference of mammal divergence [17] is remarkably sensitive to rate model assumptions, such that their results are difficult to place on Fig. 1. Even for their favoured STAR tree and gene-wise partitioning for MCMCtree, the primary interordinal diversification midpoint varies from 68.0 Ma with independent rates to 94.7 Ma with autocorrelated rates. Further substantial dating differences across partitioning schemes might also raise possible concerns about the underlying data (also see [49]), but two other issues are worth considering within our present context. Liu et al. [17] calibrate several very large, long-lived mammal clades, and 16 of 19 maximum bounds were defined by the presence of a stem lineage taxon (often the oldest, and with variously putative to well-agreed support). Maximum bounds should never be based on a specific fossil taxon – a practice that cannot account for sampling artefacts, and yet, when there is a good fossil record, can depend less on the age of the crown group being calibrated and more on the divergence from its sister taxon.
We employed Liu et al.’s [17] genomic data with our dR40 calibration scheme on the relevant nodes after deleting the large, long-lived taxa. The resulting timetrees (Additional file 2) provide far closer agreement between independent and autocorrelated rates models. Liu et al. [17] favoured the independent rates model over autocorrelated rates, based on several simulated and empirical tests. Under the independent rates model the placental diversification midpoint is 63.2 Ma, and the initial divergences within Laurasiatheria, Euarchontoglires and Afrotheria closely co-occur (all within 2.3 Ma) instead of being spread over 7.6 Ma as in Liu et al. [17]. Hence, with more rigorous calibration and reducing the potential for error-shift inflation, genome-scale data support the soft explosive model of placental evolution.
Molecular rates and life history traits among early placental mammals
Focusing calibration on clades that maintain ancestral evolutionary rates (or life history rate correlates) is the critical element shared by our most accurate dates for the simulated data and our empirical estimates for a placental origin younger than 80 Ma and major diversification near the 66 Ma KPg event (Fig. 2). This finding was foreshadowed by Phillips [11] showing that molecular rates for placental, marsupial and monotreme stem lineages were reliably traced back into the Mesozoic when calibrating clades that retain inferred ancestral life history traits, whereas calibrating only among large, long-lived mammals resulted in implausibly old divergences.
Inference of life history rate correlates from fossils also predicts that early eutherians had at least moderate rates of molecular evolution. All of the thousands of eutherian fossils from the period (Albian-Campanian: 113–72.1 Ma) that covers nearly all molecular date estimates for the origin and subsequent interordinal diversification of placentals were from small animals (< 250 g adult body mass) [50, 51]. Lifespans of these extinct eutherians were also likely to have been relatively short, because maximum longevity among all similarly small modern, non-volant and non-fossorial placentals is less than 20 years (mean 7.2 years; 95% CI 2.7–17.9 years, AnAge Database [52]).
One molecular argument against short longevity and high molecular rates among early placentals needs to be addressed. Romiguier et al. [18] analysed genomic protein coding GC content at 3rd positions (GC3) and found a remarkable correlation between GC3 conservation and longevity. They estimated maximum longevity of 25.7–40.9 years for early placentals, which is well beyond the range noted above for modern eutherians that are as small as their Albian-Campanian counterparts. However, Romiguier et al.’s [18] GC3 conservation metric is a function of time since divergence, and they assumed that crown placentals originated at 105 Ma.
Romiguier et al. [18] presented a time-correlated index of GC3 conservation, γ = −t/log(τ), where t is time since divergence and τ is Kendall’s correlation coefficient for GC3 conservation among genes, between species. We recalculated γ for each of Romiguier et al.’s [18] GC3 conservation coefficients (τ) for taxon pairs, but with divergence estimates from Phillips [11]. We confirm the strong correlation between γ and maximum longevity (R2 = 0.91; maximum longevity = 0.0683γ – 10.243). This relationship allows divergence estimates for the origin of placental mammals to be cross validated against life history inferences drawn from the fossil record. If we use our mean 77 Ma estimate for the placental origin from the dR32/dR40 analyses, the maximum longevity estimate for early placentals falls dramatically, to 7.9–21.9 years (Additional file 4), and is now consistent with many modern, small placentals. Thus, the emerging picture is of placental mammals with size and longevity similar to tree shrews, inheriting the post-KPg world and rapidly diversifying into the ecospace opened up by the extinction of dinosaurs and many other land vertebrates.
Molecular dating adaptive radiations
O’Leary et al. [5] argue for both the origin and major diversification of crown placentals at the KPg, but they did not account for fossil sampling errors. Unlike for some divergences within or between placental orders, unambiguous apomorphies for the placental crown are unclear, and biogeography reconstructions [6] give substantial probability to their origins being outside well-sampled Cretaceous mammal fossil faunas (e.g. in Africa). So we should not expect a close match between molecular estimates for the placental crown age and their earliest fossil records. Yet, the KPg molecular evolutionary rate spike that Springer et al. [29] claim for explosive models was produced by forcing this “hard” explosive model, which compresses the placental origin and > 15 Ma of evolution on our “soft” explosive tree (Fig. 3a) into just 200,000 years – an extreme scenario that they dismissed (but see [53]). In contrast, our “soft” explosive model places the placental origin at ~ 76–81 Ma and the subsequent interordinal diversification (not the placental origin) near the KPg, and molecular rate estimates for placentals remain much the same across the KPg [11]. However, parallel rate slowdowns occur in large-bodied, long-lived clades, such as whales and seacows [11], which upon calibration provide strong upwards pressure on interordinal divergences. Similar rate-shift inflation may be promoted in birds by parallel rate slowdowns, for example, among penguins and tubenoses [54].
We expect that the three key elements of error-shift inflation will often be associated with adaptive radiations. The first is that evolutionary races into novel ecospaces, which involve negotiating complex fitness landscapes, will favour species with large effective population sizes and high substitution rates [55,56,57], and these will typically be smaller, shorter-lived species. Much the same is predicted by theory around Cope’s rule [58, 59] for the tendency for radiations to proceed from smaller to larger body size. The second element, is that once large body size does evolve, fossil sampling improves [60] and allometry drives apomorphy [61]. These factors tend to promote tighter minimum bounds, which combined with the rate deceleration concomitant with large body size, provides the basis for error-shift inflation. The third factor that is typical for adaptive radiations is that maximum bounds are often necessarily conservative for calibrations deeper in the tree, if they rely on detecting smaller, more plesiomorphic taxa. This in turn reduces the effectiveness of these maximum bounds for buffering against error-shift inflation associated with underestimation of parallel rate deceleration among large, long-lived taxa.
Conclusions
In the present study our simulations based on empirical rate variation show that error-shift inflation associated with parallel rate deceleration among large, long-lived placentals can explain the proposed overestimation of interordinal divergences among molecular dating analyses. We have overcome error-shift inflation by focusing taxon sampling (or calibration) on mammals with more plesiomorphic life history rate-correlates, and by reducing asymmetrical confidence in assigning minimum and maximum calibration bounds. As a result, the most profound diversification event in placental mammal history is brought into temporal agreement between molecular dates and the fossil record (Fig. 1). A similar soft explosive model of diversification immediately following the KPg is now emerging among birds, within both Neoaves [19, 54, 62] and palaeognaths [63]. Better understanding the relationship between natural history rate-correlates and calibration strategies may be important for resolving molecular dating/fossil record controversies for other adaptive radiations, such as for the Cambrian explosion of metazoans, and for flowering plants.
Methods
Simulating molecular rate evolution and error-shift inflation among placental mammals
We simulated mammalian molecular data to understand whether realistic patterns of molecular rate variation, including parallel rate decelerations among large, long-lived taxa could explain interordinal divergence overestimates, when controlling for calibration. For each set of simulations we used Seq-Gen 1.3.3 [64] to generate 100 datasets of 20,000 bp sequences for a 12-taxon phylogeny (Fig. 2a) that is simplified from the proposed mammalian timetree of Phillips [11]. In addition to “monotreme” and “marsupial” outgroups, the “placental” ingroup has its crown origin at 80 Ma, with two daughter nodes at 66 Ma (mimicking superordinal divergences, such as Laurasiatheria and Afrotheria), and each splitting into two 33 Ma clades.
In the first set of simulations, which we refer to as “ancestral rates”, the branch rates are randomly drawn from a lognormal distribution (ln mean − 6.523, s.d. 0.274) modelled on inferred rates for small to mid-sized mammals (< 30 kg adult body mass, < 40 years maximum longevity) from [11], based on the 26-gene, 169-taxon dataset of Meredith et al. [2]. A second set of simulations that we refer to as “mixed rates” draws from the “ancestral rates” distribution for most of the tree, but mimics large, long-lived taxa for two 33 Ma clades diverging from nodes I and III in Fig. 2. These rates are drawn from the same lognormal distribution, but scaled to 1/5, similar to whales or seacows, from Phillips [11].
Timetrees for each simulated dataset were inferred separately in MCMCtree [25, 26], using the independent rates model. Calibrations were all symmetric, with 2.5% soft bound minima and maxima equidistant from the “true” simulated age. These age bounds are shown in Fig. 2b for all calibrated nodes. The simulated datasets were analysed either with all six calibrations (full calibration) or without calibrating the two clades (I & III) that exhibit the rate deceleration (ancestral rate nodes calibration).
Empirical data and deleting large, long-lived taxa
Mammalian timetrees were estimated from two DNA datasets based on the 26-gene (35,603 bp), 169-taxon alignment of Meredith et al. [2]. The first is the 122-taxon dataset, for which Springer et al. [10] had deleted all taxa included by Meredith et al. [2] that are > 10 kg and/or > 40 years maximum longevity. The second dataset (128 taxa) includes additional mammals up to 30 kg, to test the sensitivity of the date estimates to including medium sized mammals well outside the upper size bound of any Mesozoic eutherians, but that are not especially long lived (still < 40 years maximum longevity). In addition, we estimated timetrees from Liu et al.’s [17] three favoured “first quintile” 200-gene alignments, again including only the 57 taxa that are < 10 kg and < 40 years maximum longevity.
The fossil calibration bounds employed for each of the empirical timetree analyses are provided in Additional file 3, and joint marginal priors are provided in Additional file 2. To summarize, our initial analysis of the dataset for 122 taxa with presumed plesiomorphic life histories employs the calibration scheme of Phillips [11], except for calibrations on nodes deleted by Springer et al. [10]. Most placental mammal calibrations were originally based on [12]. Next we added eight additional, well-supported calibrations, including from among those that Springer et al. [10] implied would increase our divergence estimates, lifting the number of calibrations to 40. A further three calibrations were added upon the inclusion of additional taxa up to 30 kg for the 128-taxon dataset. Twenty-four of our favoured calibrations were compatible with the taxon sampling for the alignments derived from Liu et al. [17].
Geomolecular dating with MCMCtree
All timetrees based on empirical and simulated data were inferred with MCMCtree, within PAML [28]. Both the independent rates and autocorrelated rates models were employed for the 122-taxon and 128-taxon empirical datasets, with control-file priors and run parameters replicating Springer et al. [10]. This includes unit time (100 Ma), the rate prior parameters, rgene_gamma shape (1) and scale (5.41), and the rate drift prior parameters, sigma_gamma shape (1) and scale (4.207). Analyses were run for 200,000 generations, sampled every 50th generation, and a burnin of 10,000 generations was discarded. The 57-taxon alignments were similarly run in MCMCtree, although matching the original priors used by Liu et al. [17], including root age (4.16–4.254 Ma) and rgene_gamma (2, 40).
Rate distributions for the simulated datasets were based on the empirical data of Meredith et al. [2], with rate estimates taken from Phillips (Figure five in [11]; also see “Results and Discussion”). In the case of the “ancestral rates” simulations, rates were modelled only from branches representing mammals < 30 kg adult body mass and < 40 years maximum longevity. Given the rate estimate for these data of 0.1469 subs per 100 Ma, the rgene_gamma scale parameter was adjusted to 6.81 (=1/0.1469). The “mixed rates” analyses include four 33 Ma branches with 1/5 the ancestral rate, and as such the rgene_gamma scale parameter was adjusted to 7.51. The root age prior for all analyses of simulated data was 200 Ma (with sigma_gamma scale 2.0), with the root being symmetrically calibrated with soft 2.5% prior minimum and maximum bounds from 180 to 220 Ma.
Eutherian mammal diversification in the fossil record
Direct reading of the eutherian fossil record implies an extraordinary diversification immediately following the 66 Ma KPg event [7, 8, 11]. However, Springer et al. [10] advocate other diversification spikes well before the KPg, during the Turonian (93.9–89.3 Ma) and Campanian (83.6–72.1 Ma). They also suggest another diversification spike after the KPg, during the Ypresian (56.0–47.8 Ma). However, it is important to consider fossil sampling. A stage with a short duration and poor sampling will artefactually appear to have few new species appearances, while the same actual diversification rate will result in many more new species appearances for a longer, and better sampled stage, especially if it follows a stage in which new appearances were masked by poor sampling.
We obtained fossil species richness and new appearance counts from The Paleobiology Database (accessed 29 March 2017). To help even out sampling potential we start with the critical (and well-sampled) Campanian, Maastrichtian and Paleocene, and then provide further time bins as individual or combined stages that sample at least 80 mammal species. Mammals overall provide a better indicator of sampling potential than eutherians, which are expected to have very low species richness close to their origin. Our strategy resulted in relatively even bin durations (average 8.78 Ma, s.d. 2.17 Ma, see Fig. 1, Additional file 5), except for the oldest bin, Albian-Cenomanian (19.1 Ma duration), which is outside the range of molecular and morphological predictions for the diversification spike. A second important factor that Springer et al. [10] did not consider for either fossil or molecular diversification analysis is the standing diversity base from which new fossil appearances derive, or from which new molecular lineages diverge, as is standard in lineage through time analysis (see [16, 65]).
Our metric for eutherian diversification is the number of new eutherian species appearances for the time bin, divided by both the duration of the time bin and the standing diversity of eutherians in the previous time bin. Fossil sampling potential is still unlikely to be constant across all of the time bins. Therefore, to integrate out much of the sampling disparity we also show new eutherian appearances in each bin as a proportion of new appearances among all mammals (indicated by colour scaling in Fig. 1, also see Additional file 5).
Abbreviations
- CI:
-
Credible interval
- KPg:
-
Cretaceous-Paleogene boundary
- Ma:
-
Mega-anna (millions of years)
References
-
Bininda-Emonds ORP, Cardillo M, Jones KE, MacPhee RDE, Beck RMD, Grenyer R, Price SA, Vos RA, Gittleman JL, Purvis A. The delayed rise of present-day mammals. Nature. 2007;446(7135):507–12.
Article
PubMed
CASGoogle Scholar
-
Meredith RW, Janečka JE, Gatesy J, Ryder OA, Fisher CA, Teeling EC, Goodbla A, Eizirik E, Simão TLL, Stadler T, et al. Impacts of the cretaceous terrestrial revolution and KPg extinction on mammal diversification. Science. 2011;334(6055):521–4.
Article
PubMed
CASGoogle Scholar
-
Tarver JE, dos Reis M, Mirarab S, Moran RJ, Parker S, O’Reilly JE, King BL, O’Connell MJ, Asher RJ, Warnow T, et al. The interrelationships of placental mammals and the limits of phylogenetic inference. Genome Biol Evol. 2016;8(2):330–44.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Wible JR, Rougier GW, Novacek MJ, Asher RJ. The eutherian mammal Maelestes gobiensis from the late cretaceous of Mongolia and the phylogeny of cretaceous Eutheria. Bull Am Mus Nat Hist. 2009;316:1–123.
Article
Google Scholar
-
O’Leary MA, Bloch JI, Flynn JJ, Gaudin TJ, Giallombardo A, Giannini NP, Goldberg SL, Kraatz BP, Luo ZX, Meng J, et al. The placental mammal ancestor and the post-K-Pg radiation of placentals. Science. 2013;339(6120):662–7.
Article
PubMed
CASGoogle Scholar
-
Springer MS, Meredith RW, Janecka JE, Murphy WJ. The historical biogeography of Mammalia. Phil Trans Roy Soc B. 2011;366(1577):2478–502.
Article
Google Scholar
-
Alroy J. The fossil record of north American mammals: evidence for a Paleocene evolutionary radiation. Syst Biol. 1999;48(1):107–18.
Article
PubMed
CASGoogle Scholar
-
Longrich NR, Scriberas J, Wills MA. Severe extinction and rapid recovery of mammals across the cretaceous–Palaeogene boundary, and the effects of rarity on patterns of extinction and recovery. J Evol Biol. 2016;29(8):1495–512.
Article
PubMed
CASGoogle Scholar
-
Bininda-Emonds ORP, Purvis A. Comment on “impacts of the cretaceous terrestrial revolution and KPg extinction on mammal diversification”. Science. 2012;337(6090):34.
Article
PubMed
CASGoogle Scholar
-
Springer MS, Emerling CA, Meredith RW, Janečka JE, Eizirik E, Murphy WJ. Waking the undead: implications of a soft explosive model for the timing of placental mammal diversification. Mol Phylogenet Evol. 2017;106:86–102.
Article
PubMedGoogle Scholar
-
Phillips MJ. Geomolecular dating and the origin of placental mammals. Syst Biol. 2016;65(3):546–57.
Article
PubMedGoogle Scholar
-
dos Reis M, Inoue J, Hasegawa M, Asher RJ, Donoghue PCJ, Yang Z. Phylogenomic datasets provide both precision and accuracy in estimating the timescale of placental mammal phylogeny. Proc Roy Soc B. 2012;279(1742):3491–500.
Article
Google Scholar
-
Parham JF, Donoghue PCJ, Bell CJ, Calway TD, Head JJ, Holroyd PA, Inoue JG, Irmis RB, Joyce WG, Ksepka DT, et al. Best practices for justifying fossil calibrations. Syst Biol. 2012;61(2):346–59.
Article
PubMedGoogle Scholar
-
Benton MJ. Early origins of modern birds and mammals: molecules vs. morphology. Bioessays. 1999;21(12):1043–51.
Article
PubMed
CASGoogle Scholar
-
Simpson GG. The principles of classification and a classification of mammals. Bull Am Mus Nat Hist. 1945;85:1–307.
Google Scholar
-
Foote M, Hunter JP, Janis CM, Sepkoski JJ. Evolutionary and preservational constraints on origins of biologic groups: divergence times of eutherian mammals. Science. 1999;283(5406):1310–4.
Article
PubMed
CASGoogle Scholar
-
Liu L, Zhang J, Rheindt FE, Lei FM, Qu YH, Wang Y, Zhang Y, Sullivan C, Nie WH, Wang JH, et al. Genomic evidence reveals a radiation of placental mammals uninterrupted by the KPg boundary. Proc Natl Acad Sci U S A. 2017;114(35):E7282–90.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Romiguier J, Ranwez V, Douzery EJP, Galtier N. Genomic evidence for large, long-lived ancestors to placental mammals. Mol Biol Evol. 2013;30(1):5–13.
Article
PubMed
CASGoogle Scholar
-
Jarvis ED, Mirarab S, Aberer AJ, Li B, Houde P, Li C, Ho SYW, Faircloth BC, Nabholz B, Howard JT, et al. Whole-genome analyses resolve early branches in the tree of life of modern birds. Science. 2014;346(6215):1320–31.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Mitchell KJ, Cooper A, Phillips MJ. Comment on “whole-genome analyses resolve early branches in the tree of life of modern birds”. Science. 2015;349(6255):1460.
Article
PubMed
CASGoogle Scholar
-
Beaulieu JM, O’Meara BC, Crane P, Donoghue MJ. Heterogeneous rates of molecular evolution and diversification could explain the Triassic age estimate for angiosperms. Syst Biol. 2015;64(5):869–78.
Article
PubMed
CASGoogle Scholar
-
Brown JW, Smith SA. The past sure is tense: on interpreting phylogenetic divergence time estimates. Syst Biol. 2018;67:340–53.
Article
PubMedGoogle Scholar
-
Foster CSP, Sauquet H, Van der Merwe M, McPherson H, Rossetto M, Ho SYW. Evaluating the impact of genomic data and priors on Bayesian estimates of the angiosperm evolutionary timescale. Syst Biol. 2017;66(3):338–51.
PubMed
Google Scholar
-
Lee MSY, Soubrier J, Edgecombe GD. Rates of phenotypic and genomic evolution during the Cambrian explosion. Curr Biol. 2013;23(19):1889–95.
Article
PubMed
CASGoogle Scholar
-
Yang Z. PAML 4: phylogenetic analysis by maximum likelihood. Mol Biol Evol. 2007;24(8):1586–91.
Article
PubMed
CASGoogle Scholar
-
Yang Z, Rannala B. Bayesian estimation of species divergence times under a molecular clock using multiple fossil calibrations with soft bounds. Mol Biol Evol. 2006;23(1):212–26.
Article
PubMed
CASGoogle Scholar
-
Lane A, Janis CM, Sepkoski JJ. Estimating paleodiversities: a test of the taxic and phylogenetic methods. Paleobiology. 2005;31(1):21–34.
Article
Google Scholar
-
Springer MS, Burk-Herrick A, Meredith R, Eizirik E, Teeling E, O’Brien SJ, Murphy WJ. The adequacy of morphology for reconstructing the early history of placental mammals. Syst Biol. 2007;56(4):673–84.
Article
PubMedGoogle Scholar
-
Springer MS, Meredith RW, Teeling EC, Murphy WJ. Technical comment on “the placental mammal ancestor and the post-K-Pg radiation of placentals”. Science. 2013;341(6146):613.
Article
PubMed
CASGoogle Scholar
-
Herrera JP, Dávalos LM. Phylogeny and divergence times of lemurs inferred with recent and ancient fossils in the tree. Syst Biol. 2016;65(5):772–91.
Article
PubMedGoogle Scholar
-
Marivaux L, Ramdarshan A, Essid EM, Marzougui W, Ammar HK, Lebrun R, Marandat B, Merzeraud G, Tabuce R, Vianey-Liaud M. Djebelemur, a tiny pre-tooth-combed primate from the Eocene of Tunisia: a glimpse into the origin of crown strepsirhines. PLoS One. 2013;8(12):e80778.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Rose KD, DeLeon VB, Missiaen P, Rana RS, Sahni A, Singh L, Smith T. Early Eocene lagomorph (Mammalia) from western India and the early diversification of Lagomorpha. Proc Roy Soc B. 2008;275(1639):1203–8.
Article
Google Scholar
-
Matthee CA, van Vuuren BJ, Bell D, Robinson TJ. A molecular supermatrix of the rabbits and hares (Leporidae) allows for the identification of five intercontinental exchanges during the Miocene. Syst Biol. 2004;53(3):433–47.
Article
PubMedGoogle Scholar
-
Zhang Z, Li C, Wang J. Presence of the calcaneal canal in basal Glires. Vertebrata PalAsiatica. 2016;54(3):235–42.
Google Scholar
-
Storch G, Sigé B, Habersetzer J. Tachypteron franzeni n. Gen., n. Sp., earliest emballonurid bat from the middle Eocene of Messel (Mammalia, Chiroptera). Paläontol Z. 2002;76(2):189–99.
Article
Google Scholar
-
Teeling EC, Springer MS, Madsen O, Bates P, Brien SJ, Murphy WJ. A molecular phylogeny for bats illuminates biogeography and the fossil record. Science. 2005;307:580–4.
Article
PubMed
CASGoogle Scholar
-
Maitre E, Sigé B, Escarguel G. A new family of bats in the Paleogene of Europe: systematics and implications for the origin of emballonurids and rhinolophoids. Neues Jahrbuch fur Geologie und Palaontologie-Abhandlungen. 2008;250(2):199–216.
Article
Google Scholar
-
Ravel A, Adaci M, Bensalah M, Charruault A-L, Essid EM, Ammar HK, Marzougui W, Mahboubi M, Mebrouk F, Merzeraud G, et al. Origine et radiation initiale des chauves-souris modernes: nouvelles découvertes dans l’Éocène d’Afrique du Nord. Geodiversitas. 2016;38(3):355–434.
Article
Google Scholar
-
Brown TM, Schankler D. A review of the Proteutheria and Insectivora of the Willwood formation (lower Eocene) Bighorn Basin, Wyoming. U S Geol Surv Bull. 1982;1523:1–79.
Google Scholar
-
Novacek MJ, Bown TM, Schankler DM. On the classification of early tertiary Erinaceomorpha (Insectivora, Mammalia). Am Mus Novit. 1985;2813:1–22.
Google Scholar
-
Hooker JJ, Russell DE. Early Palaeogene Louisinidae (Macroscelidea, Mammalia), their relationships and north European diversity. Zool J Linnean Soc. 2012;164(4):856–936.
Article
Google Scholar
-
Secord R. The Tiffanian land-mammal age (middle and late Paleocene) in the northern Bighorn Basin, Wyoming. Univ Mich Pap Paleontology. 2008;35:1–192.
Google Scholar
-
Barnett R, Barnes I, Phillips MJ, Larry D, Martin C, Leonard JA, Cooper A. Evolution of the extinct sabretooths and the American cheetah-like cat. Proc Natl Acad Sci U S A. 2005;101:1626–31.
Google Scholar
-
Phillips MJ. Four mammal fossil calibrations: balancing competing palaeontological and molecular considerations. Palaeontol Electron. 2015;18(1):1–16.
Google Scholar
-
Benton MJ, Donoghue PC, Asher RJ, Friedman M, Near TJ, Vinther J. Constraints on the timescale of animal evolutionary history. Palaeontol Electron. 2015;18(1):1–106.
Google Scholar
-
Emerling CA, Huynh HT, Nguyen MA, Meredith RW, Springer MS. Spectral shifts of mammalian ultraviolet-sensitive pigments (short wavelength-sensitive opsin 1) are associated with eye length and photic niche evolution. Proc Roy Soc B. 2015;282:2015817.
Article
CASGoogle Scholar
-
Halliday TJD, Upchurch P, Goswami A. Eutherians experienced elevated evolutionary rates in the immediate aftermath of the cretaceous — Palaeogene mass extinction. Proc Roy Soc B. 2016;283:20153026.
Article
CASGoogle Scholar
-
Ronquist F, Lartillot N, Phillips MJ. Closing the gap between rocks and clocks using total-evidence dating. Phil Trans Roy Soc B. 2016;371:20150136.
Article
Google Scholar
-
Gatesy J, Springer MS. Phylogenomic red flags: homology errors and zombie lineages in the evolutionary diversification of placental mammals. Proc Natl Acad Sci U S A. 2017;114:E9431–2.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Slater GJ. Phylogenetic evidence for a shift in the mode of mammalian body size evolution at the cretaceous-Palaeogene boundary. Methods Ecol Evol. 2013;4(8):734–44.
Article
Google Scholar
-
Halliday TJD, Goswami A. The impact of phylogenetic dating method on interpreting trait evolution: a case study of cretaceous–Palaeogene eutherian body-size evolution. Biol Lett. 2016;12:20160051.
Article
PubMed
PubMed CentralGoogle Scholar
-
de Magalhaes JP, Costa J. A database of vertebrate longevity records and their relation to other life-history traits. J Evol Biol. 2009;22(8):1770–4.
Article
PubMed
CASGoogle Scholar
-
Beck RMD, Lee MSY. Ancient dates or accelerated rates? Morphological clocks and the antiquity of placental mammals. Proc Roy Soc B. 2014;281:20141278.
Article
Google Scholar
-
Ksepka DT, Phillips MJ. Avian diversification patterns across the K-Pg boundary: influence of calibrations, datasets, and model misspecification. Ann Mo Bot Gard. 2015;100:300–28.
Article
Google Scholar
-
Gavrilets S, Vose A. Dynamic patterns of adaptive radiation. Proc Natl Acad Sci U S A. 2005;102:18040–5.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Charlesworth B. Effective population size and patterns of molecular evolution and variation. Nat Rev Genet. 2009;10:195–205.
Article
PubMed
CASGoogle Scholar
-
Lynch M, Abegg A. The rate of establishment of complex adaptations. Mol Biol Evol. 2010;27(6):1404–14.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Rensch B. Histological changes correlated with evolutionary changes of body size. Evolution. 1948;2(3):218–30.
Article
PubMed
CASGoogle Scholar
-
Polly PD. Cope’s rule. Science. 1998;282(5386):47.
Article
Google Scholar
-
Kidwell SM, Flessa KW. The quality of the fossil record: populations, species, and communities. Annu Rev Ecol Syst. 1995;26(1):269–99.
Article
Google Scholar
-
Marroig G, Cheverud JM. Size as a line of least evolutionary resistance: diet and adaptive morphological radiation in new world monkeys. Evolution. 2005;59(5):1128–42.
Article
PubMedGoogle Scholar
-
Prum RO, Berv JS, Dornburg A, Field DJ, Townsend JP, Lemmon EM, Lemmon AR. A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 2015;526(7574):569–73.
Article
PubMed
CASGoogle Scholar
-
Grealy A, Phillips M, Miller G, Gilbert MT, Rouillard JM, Lambert D, Bunce M, Haile J. Eggshell palaeogenomics: Palaeognath evolutionary history revealed through ancient nuclear and mitochondrial DNA from Madagascan elephant bird (Aepyornis sp.) eggshell. Mol Phylogenet Evol. 2017;109:151–63.
Article
PubMed
CASGoogle Scholar
-
Rambaut A, Grassly NC. Seq-gen: an application for the Monte Carlo simulation of DNA sequence evolution along phylogenetic trees. Bioinformatics. 1997;13(3):235–8.
Article
CASGoogle Scholar
-
Rabosky DL. Likelihood methods for detecting temporal shifts in diversification rates. Evolution. 2006;60(6):1152–64.
Article
PubMedGoogle Scholar
-
Lartillot N, Phillips MJ, Ronquist F. A mixed relaxed clock model. Phil Trans Roy Soc B. 2016;371:20150132.
Article
Google Scholar
-
Murphy WJ, Pringle TH, Crider TA, Springer MS, Miller W. Using genomic data to unravel the root of the placental mammal phylogeny. Genome Res. 2007;17(4):413–21.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Springer MS, Murphy WJ, Eizirik E, O’Brien SJ. Placental mammal diversification and the cretaceous–tertiary boundary. Proc Natl Acad Sci U S A. 2003;100(3):1056–61.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Kumar S, Stecher G, Suleski M, Hedges SB. TimeTree: a resource for timelines, timetrees, and divergence times. Mol Biol Evol. 2017;34(7):1812–9.
Article
PubMedGoogle Scholar
Download references
Acknowledgements
We are grateful to David Penny and Peter Waddell for valuable discussions on mammalian diversification and to Robin Beck for helpful comments on the manuscript. Thomas Halliday kindly provided dated morphological trees, and Adam Stone assisted with QUT High Performance Computing. Three anonymous reviewers provided valuable comments that improved the manuscript.
Funding
This research was funded by an Australian Research Council Discovery grant (DP150104659 to MJP).
Availability of data and materials
All data analysed during this study are included in this published article and its supplementary information files, or appropriately cited and publically available from earlier studies.
Author information
Authors and Affiliations
-
School of Earth, Environmental and Biological Sciences, Queensland University of Technology, Brisbane, Australia
Matthew J. Phillips & Carmelo Fruciano
Authors
- Matthew J. Phillips
You can also search for this author in
PubMed Google Scholar - Carmelo Fruciano
You can also search for this author in
PubMed Google Scholar
Contributions
MJP designed the study, curated the fossil calibrations, simulated DNA data, ran the fossil record and longevity analyses, and wrote the manuscript. CF ran the MCMCtree analyses and collated published molecular dates. Both authors read and approved the final manuscript.
Corresponding author
Correspondence to
Matthew J. Phillips.
Ethics declarations
Ethics approval and consent to participate
Not applicable.
Consent for publication
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Additional files
Additional file1:
Addressing claims of “zombie” lineages on Phillips’ (2016) timetree. Table S1. and Figure S1. (PDF 588 kb)
Additional file 2:
MCMCtree timetrees. Table S2. Figure S2. and Figure S3. (PDF 525 kb)
Additional file 3:
Fossil calibration schemes. Table S3. and Figure S4. (PDF 583 kb)
Additional file 4:
GC3 conservation and estimating maximum longevity. Figure S5. (PDF 251 kb)
Additional file 5:
Table S4. Fossil record species richness for Eutheria and Mammalia from Albian through to Lutetian. (PDF 90 kb)
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Phillips, M.J., Fruciano, C. The soft explosive model of placental mammal evolution.
BMC Evol Biol 18, 104 (2018). https://doi.org/10.1186/s12862-018-1218-x
Download citation
-
Received: 17 October 2017
-
Accepted: 19 June 2018
-
Published: 03 July 2018
-
DOI: https://doi.org/10.1186/s12862-018-1218-x
Keywords
- Cretaceous-Paleogene boundary
- Fossil calibration
- Life history
- Molecular dating
- Placentalia
- Research article
- Open Access
- Published: 03 July 2018
BMC Evolutionary Biology
volume 18, Article number: 104 (2018)
Cite this article
-
5302 Accesses
-
25 Citations
-
107 Altmetric
-
Metrics details
Abstract
Background
Recent molecular dating estimates for placental mammals echo fossil inferences for an explosive interordinal diversification, but typically place this event some 10–20 million years earlier than the Paleocene fossils, among apparently more “primitive” mammal faunas.
Results
However, current models of molecular evolution do not adequately account for parallel rate changes, and result in dramatic divergence underestimates for large, long-lived mammals such as whales and hominids. Calibrating among these taxa shifts the rate model errors deeper in the tree, inflating interordinal divergence estimates. We employ simulations based on empirical rate variation, which show that this “error-shift inflation” can explain previous molecular dating overestimates relative to fossil inferences. Molecular dating accuracy is substantially improved in the simulations by focusing on calibrations for taxa that retain plesiomorphic life-history characteristics. Applying this strategy to the empirical data favours the soft explosive model of placental evolution, in line with traditional palaeontological interpretations – a few Cretaceous placental lineages give rise to a rapid interordinal diversification following the 66 Ma Cretaceous-Paleogene boundary mass extinction.
Conclusions
Our soft explosive model for the diversification of placental mammals brings into agreement previously incongruous molecular, fossil, and ancestral life history estimates, and closely aligns with a growing consensus for a similar model for bird evolution. We show that recent criticism of the soft explosive model relies on ignoring both experimental controls and statistical confidence, as well as misrepresentation, and inconsistent interpretations of morphological phylogeny. More generally, we suggest that the evolutionary properties of adaptive radiations may leave current molecular dating methods susceptible to overestimating the timing of major diversification events.
Background
Molecular and palaeontological analyses of placental mammals both identify an interordinal diversification spike, in which the stem lineages of nearly all 18 modern orders (e.g. primates, rodents) originated over a period of just a few million years (Ma). However, most molecular dating estimates (e.g. [1,2,3]) for this diversification are 10–20 Ma older than observed in the fossil record [4, 5]. The extraordinary fossil record surge for eutherians (crown placentals and their extinct stem relatives) follows the 66 Ma Cretaceous-Paleogene boundary (KPg) mass extinction event (Fig. 1). This fossil record diversification also manifests as a taxonomic phase change, with eutherians as a percentage of new mammal species appearances increasing from an average of 27% during the Campanian and Maastrichtian, to 84% during the Paleocene.

Eutherian fossil record species diversification rate. Data points are calculated as new appearances/Ma (scaled by species richness in the previous time bin, a proxy for starting species richness). Barremian-Aptian provides the previous time bin for Albian-Cenomanian. The green-blue colour shading indicates the proportion of eutherians among mammal first appearances for each time bin. Referenced arrows indicate molecular dating estimates for the temporal midpoint of the placental interordinal diversification, including for Laurasiatheria, Euarchontoglires and Afrotheria (See Additional file 2: Table S2). The KPg boundary is shown as red dashes. Tur-San, Turonian to Santonian; Maa, Maastrichtian [1,2,3], [10,11,12] [66,67,68,69]
Full size image
If the older molecular dates for the interordinal diversification are instead correct, then this most profound event in placental history leaves no discernible trace in the fossil record (Fig. 1). This is especially perplexing, because ancestral area reconstruction [6] places this proposed ~ 75–85 Ma molecular radiation (including stem members of all 11 Northern Hemisphere orders) right alongside the best Late Cretaceous fossil faunas in Eurasia and North America. It is similarly incongruous that during the diversity surge in the placental fossil record following the KPg mass extinction [7, 8] those same molecular timetrees instead imply stable or even declining diversification [2, 9]. Springer et al.’s [10] new tree does place several additional primate and rodent divergences close to the KPg relative to [2], but this may be an artefact of adding maximum bounds at the KPg for these clades to bump up against.
Phillips [11] recently presented evidence for two methodological contributors to molecular dates overestimating early divergences among placentals: (1) Molecular clocks over-smooth parallel decelerations in evolutionary rates among large, long-lived mammals. This results in several-fold divergence underestimates in groups such as whales and seacows, for which calibration to correct these clade ages simply transfers the underlying rate error stemwards, and inflates divergence estimates deeper in the tree. (2) Such “error-shift inflation” is further facilitated by asymmetry in calibration priors between minimum bounds that are highly speculative, and maximum bounds that are too conservative to buffer against rate misspecification or erroneous minimum bounds at other nodes.
Phillips [11] sought to ameliorate error-shift inflation in two steps. The first reduced the impact of oversmoothed, parallel rate decelerations on dates deeper in the tree, by employing dos Reis et al.’s [12] calibration scheme – which includes fewer constraints among large, long-lived taxa than does Meredith et al.’s [2] scheme. The second step reduced asymmetry in fossil calibration priors, by revising overly conservative maximum bounds in line with best practices [13], so as to enhance the capacity of the calibration scheme to buffer against rate errors. The revised calibration scheme was then used to reanalyse Meredith et al.’s [2] 26-locus dataset for 169 taxa, and resulted in molecular dates that closely matched long-held fossil record expectations [14,15,16]. We refer to this as the “soft explosive” model of placental evolution; a few Cretaceous placental lineages seed the massive interordinal diversification spike that follows the KPg extinction event. In contrast, the “hard explosive” model [4, 5] places both the placental origin and initial radiation near or after the KPg.
Although the soft explosive model brings agreement between molecular and fossil inference of placental evolution, it has recently been criticized by Springer et al. [10] on two grounds. The first criticism is that Phillips [11] erroneously dragged divergences younger by “eliminating calibrations in large-bodied/long lifespan clades” without deleting those taxa. This claim is false. Phillips [11] maintained each of dos Reis et al.’s [12] calibrations that were placed in large-bodied/long lifespan clades. Springer et al.’s [10] argument was also based on an analysis in which they deleted large, long-lived taxa, and found that most supraordinal divergences increased by 8–10 Ma relative to Phillips [11]. However, Springer et al. [10] failed to control for calibration, and it is not their taxon deletion, but their inclusion of poorly supported calibrations that drives the divergence estimates older (as discussed below; also see Additional file 1). Indeed, when we repeat their taxon deletion, but maintain the original calibration scheme of Phillips [11], the divergence estimates again support the soft explosive model (dR32 analysis, Table 1C).
Full size table
Springer et al.’s [10] second criticism of the soft explosive model was that many divergences post-date the earliest fossil evidence for the clade, thus implying the existence of fossil “zombie” lineages. We will show that this criticism is based on misrepresentation, false precision in their interpretation of molecular dates, and overconfidence in poorly resolved fossil relationships.
One point of agreement in the debate over the timescale of placental evolution is that calibrating among large, long-lived taxa results in older age estimates for the root and interordinal divergences [2, 10, 11]. Nevertheless, attempting to understand and quantify the contribution from error-shift inflation may be confounded by variation in calibration precision (how closely fossil calibrations match true divergences) – which may differ between the deleted large, long-lived calibrations and the remaining calibrations. Here we use simulations based on empirical estimates of molecular rate variation among placentals to control for calibration accuracy and precision, and to better understand the influence of error-shift inflation.
Considered together, our simulation study and new molecular dates based on revised fossil calibrations for the datasets of Meredith et al. [2] and Liu et al. [17] provide strong support for the soft explosive model of placental diversification. Moreover, previous, older molecular dates are explained as artefacts of errors in both calibration and modelling rate variation across the tree. In turn, the younger KPg diversification allows us to revise Romiguier et al.’s [18] surprising molecular inference of early placental life history traits. More generally, there is a wider pattern of conflict between molecular dates and fossil evidence for the timing of major diversifications, such as for birds [19, 20], flowering plants [21,22,23] and the Cambrian explosion [24]. We discuss the possibility that major adaptive radiations could be particularly susceptible to error-shift inflation, resulting in molecular divergence overestimates.
Results and discussion
Simulated rate deceleration among large, long-lived taxa mimics observed molecular dating errors
To control for calibration and isolate the behaviour of error-shift inflation, we simulated molecular data on a phylogeny of given age (Fig. 2a) that is simplified from the proposed mammalian timetree of Phillips (Figure five in [11]). We simulate “placentals” originating at 80 Ma, then splitting into two 66 Ma superorders (e.g. “Laurasiatheria” and “Afrotheria”), which each give rise to two 33 Ma calibrated clades. In the first set of simulations the branch rates are randomly drawn from a lognormal distribution modelled on inferred rates from Phillips [11] for small to mid-sized mammals (< 30 kg adult body mass, < 40 years maximum longevity). Relaxed molecular clock dating in MCMCtree [25, 26] accurately reconstructs all node heights under this simple distribution of rates across the tree (Fig. 2c-e, light grey bars). However, when we simulate a parallel rate deceleration reminiscent of whales or seacows for just one of the 33 Ma calibrated nodes in each superorder, the MCMCtree reconstructions reveal extreme error-shift inflation. Average estimates for the 66 Ma superorders were inflated to 80.5 Ma, and the 80 Ma placental root was inflated to 107.9 Ma. In each case the 95% CIs are fully older than the simulated dates. These inflated divergences closely mimic recent molecular dates for placental mammals.

Simulating error-shift inflation of deep placental divergences, and amelioration by excluding calibrations among large, long-lived clades. a. Dated tree on which 20,000 bp DNA sequences were simulated under two rate schemes, “ancestral rates” with all branch rates drawn from a single lognormal distribution (see Methods) and “mixed rates” with the rate drawn from that same distribution, except divided by 5 for the daughter lineages of nodes I and III. b. Soft bound calibrations on nodes I-VI under alternative MCMCtree reconstructions. Date estimates and 95% CIs for simulated clades c “Placentalia” d “Laurasiatheria” and e “Sirenia” are shown for the “ancestral rates” simulation (light grey), and for the “mixed rates” simulation with either full calibration (black) or calibration only on ancestral rates clades (dark grey). Corresponding date estimates from Phillips ([11], Fig. 4c,d) on the empirical data are shown for f Placentalia, g Laurasiatheria and h Sirenia, with full calibration (black) and largely focusing on ancestral rates clades (dark grey)
Full size image
Our simulations also reproduce the empirical pattern of extreme dating underestimation for large, long-lived clades for when they are not calibrated. In particular, the low rate clades simulated as 33 Ma are reconstructed by MCMCtree with a mean age of 8.5 Ma, almost as extreme as the empirical pattern for seacow origins falling from ~ 28 Ma to 5.7 Ma when uncalibrated (Fig. 2e,h). Importantly though, excluding calibrations among the low rate (large, long-lived) clades allows accurate inference of divergence dates deeper in the tree, returning reconstructions close to the simulated ages (Fig. 2c,d “mixed rates ancestral calibrations” – dark grey bars). It is remarkable how closely the pattern of uncalibrating large, long-lived taxa to overcome the simulated error-shift inflation (Fig. 2c-e) mirrors the empirical pattern for placental mammals (Fig. 2f-h). Thus, our simulations, which are based on empirical rate variation, show that error-shift inflation associated with parallel rate deceleration among large, long-lived placentals can explain the proposed overestimation of interordinal divergences among molecular dating analyses.
Conjuring up “zombie” lineages
Lane et al. [27] coined the term “zombie lineage” for the extension of a taxon’s survival beyond their last fossil appearance. Springer et al. [10] re-purposed the term for molecular divergences that are younger than minimum ages implied by fossil records, and claim that Phillips’ [11] “preferred timetree” includes 61 (of 136) internal placental nodes that are younger than first fossil appearances, thus resulting in “zombie” lineages. Springer et al.’s [10] claim is based on a series of misrepresentations, which are best appreciated by first understanding how Phillips’ [11] timetree was constructed. Phillips [11] recognised that calibrating large, long-lived taxa in the tree of more plesiomorphic mammals erroneously inflates interordinal divergences (also shown here with simulations, Fig. 2c,d “full calibration” – black bars), whereas not calibrating among these taxa underestimates their own family-level divergences (Fig. 2e “mixed rates ancestral calibrations” – dark grey bar). Phillips [11] addressed this challenge in two steps. The first step inferred divergences with dos Reis et al.’s [12] calibrations, most of which are set among taxa with plesiomorphic life-history (tree 1, Fig. 4d in [11]). The final timetree (tree 2, Figure five in [11]) was then inferred with more calibrations added among large, long-lived taxa, but with maximum bounds on several superordinal clades based on broad agreement between tree 1 and fossil records for major diversification following the KPg (and also noting that multi-lineage diversifications should provide more robust markers in the fossil record than individual nodes).
Springer et al.’s [10] misrepresentation begins by overlooking Phillips’ [11] discussion of uncalibrated divergences among large, long-lived taxa being underestimated in tree 1, and falsely claiming tree 1 to be Phillips’ [11] “preferred tree”. They then ignore the final timetree with those taxa calibrated (tree 2), which Phillips [11] used for final inference of molecular rates, and instead, Springer et al. [10] set up the tree 1 dates as a straw man for comparison with fossil dates.
A careful examination of the (actually) 62 nodes that Springer et al. [10] tabled as postdating proposed fossil dates reveals that 40 involve clades of large/long-lived taxa. These underestimates follow directly from the aims for tree 1, which were to reveal the extent of date underestimation among large, long-lived clades and to isolate the interordinal nodes from error-shift inflation that would result from those large, long-lived clades being calibrated (as our simulation study confirms, Fig. 2). Springer et al. [10] perhaps agree, and deleted all 40 of those large, long-lived clades for their analysis.
The more concerning claim that Phillips [11] underestimated the age of 22 clades that retain apparently more plesiomorphic life history traits is illusory, created from false precision. Springer et al. [10] exaggerate disagreement here by treating those molecular dates as errorless, and by ignoring uncertainty in the phylogenetic attribution of reference fossils for minimum bounds. If instead we undertake the usual practices of basing fossil minimum dates on phylogenetically well-supported fossils, and considering Bayesian molecular divergences as 95% credible intervals (CIs), then the discrepancy vanishes for 20 of the 22 clades (Additional file 1). Moreover, Phillips’ [11] final molecular dates (tree 2) place the 95% CIs for the two remaining clades, Musteloidea (28.5–30.7 Ma) and Feliformia (30.3–35.3 Ma) entirely older than their respectively proposed fossil minima of 24.8 Ma and 28.1 Ma. The tree 2 analysis was primarily designed to test rate variation hypotheses, and still retains some dubious fossil calibrations from Meredith et al. [2]. But it is notable that our primary dating estimates in this study are also consistent with both of these proposed fossil minima (Additional file 2, 122-taxon dR40 trees). Thus, Springer et al.’s [10] claim of “zombie” lineages among smaller, shorter lived taxa is unfounded.
Dating the evolution of placental mammals
We have updated our calibration set to allow for eight additional well-supported calibrations (Additional file 3) that were not employed by dos Reis et al. [12], but include several that Springer et al.’s [10] list of “zombie” lineages implied would increase our divergence estimates. This lifts the number of calibration priors to 40 for the same 122 taxa with apparently plesiomorphic life histories that were employed by Springer et al. [10]. The resulting MCMCtree timetree (dR40, see Table 1D) provides very similar divergence estimates to our previous calibration schemes (Table 1A,C). The most profound diversification in placental mammal history again falls across or closely follows the KPg boundary (see Fig. 3a), including for the basal radiations of all three major superorders (Laurasiatheria, Afrotheria and Euarchontoglires).

Placental mammal ordinal-level timetrees on the 122-taxon dataset for which large, long-lived taxa are excluded. Node heights are averaged over MCMCtree independent and autocorrelated rates analyses, with 95% CIs shown for analyses under independent rates (purple bars) and autocorrelated rates (grey bars). a. using our dR40 calibration set. b. Adding additional poorly-vetted calibrations for Lorisiformes, Lagomorpha, Emballonuroidea and Erinaceidae-Soricidae, and with maximum bounds for basal Primates, Rodentia and Chiroptera increased, following Springer et al. [10]. Substituting in these “dR40Springer” calibrations inflates the midpoint for the primary placental interordinal diversification from 64.5 Ma to 72.2 Ma
Full size image
To isolate the source of the differences between our dates and Springer et al.’s [10] dates we identified poorly-vetted reference fossils that they used to define seven placental calibration minima that are older than our dR40 molecular estimates (Table 2). In several cases the temporal difference is so minor (1.5–2.8 Ma) as to have little impact deeper in the tree. However, four of Springer et al.’s [10] fossil minima are strikingly older than our molecular estimates, and reveal breathtaking inconsistency in how these authors treat morphological phylogenetic evidence. For example, Springer et al. [10, 28, 29] express valid cautions, and are highly critical of morphological phylogeny, even for well-sampled modern or Mesozoic eutherians that are analysed within objective, statistical frameworks. Yet, when it comes to calibration, Springer et al. [10] accept reference fossils based on highly fragmentary material, unverified by any formal phylogenetic analyses (matrix-based or otherwise) or that are contradicted by such analyses (see Additional file 1) – then employ these fossils as minimum bounds with 97.5% or indeed, preferentially with 100% prior probability.
Full size table
The four poorly-vetted fossils that substantially conflict with our molecular dates are:
-
(1)
The ~ 38 Ma Saharagalago (calibrating Lorisiformes) is known from just two molars. Phillips (Figure two in [11]) showed this calibration to be an extreme outlier for apparent dating error (or rate distortion). The most likely explanation is that Saharagalago (and Karanisia from the same locality) falls outside Lorisiformes, as two recent phylogenetic analyses found [30, 31].
-
(2)
The ~ 53 Ma ‘Vastan’ ankle bones (calibrating Lagomorpha) were found by Rose et al. [32] to group with Oryctolagus to the exclusion of other rabbits and hares. If true, these ankle bones would implausibly pre-date molecular dating expectations for the Oryctolagus—Sylvilagus divergence by ~ 5-fold [33]. However, Rose et al. [32] did not consider sampling error and noted that the morphological signal may be confounded by functional similarities. Zhang et al.’s [34] μCT scans have since shown that a key character, the calcaneal canal, is also present in stem lagomorphs. Our re-analysis of Rose et al. [32] excluding the calcaneal canal character places the Vastan ankle bones outside crown lagomorphs, although their affinities remain statistically unresolved (Additional file 1: Figure S1).
-
(3)
The ~ 47 Ma bat, Tachypteron (calibrating Emballonuroidea) was assigned by Storch et al. [35] only on the basis of similarities, and within a framework that considered emballonurids as sister to rhinolophoids. These two groups are now known to fall on opposite sides of the chiropteran tree [36], and some other Eocene European bats previously assigned to Emballonuridae and Rhinolophoidea have since been placed in a new family of uncertain affinities [37]. Tachypteron was not considered in that study. Ravel et al.’s [38] cladistic analysis of Tachypteron and Vespertiliavus included only emballonuroids among crown bats. Hence, the placement of Tachypteron requires confirmation, especially analysis of cranial and post-cranial material.
-
(4)
The ~ 62 Ma Adunator (calibrating Erinaceidae-Soricidae) has been considered an erinaceomorph (e.g. [39]). However, this assignment is precarious; other work questions whether Adunator even falls within Lipotyphla. Novacek et al. [40] stated that Adunator is in “limbo between primitive insectivorans and primitive condylarths”, while [41] instead place Adunator with elephant shrews. Moreover, the calibration reference (A. ladae) has not been tested in formal phylogenetic analyses, and has recently been placed a resurrected genus (Mckennatherium) with even less certain affinities [42].
The potential for interordinal divergences to be inflated by poorly-justified calibration minimum bounds (or by rate model errors) is exacerbated by overly conservative maximum bounds. Maximum bounds should cover the time back until relatively well sampled fossil assemblages in potential geographic regions of origin that contain no putative crown group members, but contain stem members or ecological equivalents [13, 43] . These conditions are met for Chiroptera in the Thanetian (base = 59.2 Ma) [44] and for both Primates and Rodentia in the Selandian (base = 61.6 Ma) [11]. Springer et al. [10] extend each of these maximum bounds by one or more additional geological stages, based on arbitrary phylogenetic bracketing from [45] or unspecified uncertainty in the case of bats, from [46].
It is now apparent that the few most problematic minimum and maximum calibration bounds listed above are the main drivers for Springer et al. [10] pushing the primary diversification of placental mammals back into the Cretaceous. This can be shown by starting with our dR40 analysis of the 122-taxon dataset, and then substituting in Springer et al.’s [10] minimum bounds for Lorisiformes, Lagomorpha, Emballonuroidea and Erinaceidae-Soricidae, and their maximum bounds for basal rodents, primates and bats. With this dR40Springer calibration set, the midpoint of the primary placental interordinal diversification shifts from 64.5 Ma, back to 72.2 Ma (Fig. 3), closely approaching Springer et al.’s [10] 74.1 Ma diversification midpoint. In contrast, our basal Paleocene estimate is in phase with the primary diversification in the fossil record (Fig. 1) and with a new generation of morphological/total evidence dating [47, 48].
Applying Springer et al.’s [10] more conservative rodent, primate and bat maximum bounds alone explains very little of the date increases shown in Fig. 3b. Substituting these older maxima into our dR40 analyses lifts the midpoint of the primary placental interordinal diversification by only 0.8 Ma, to 65.3 Ma (Additional file 2). It is only with the further inclusion of the poorly-vetted lorisiform, lagomorph, emballonuroid and erinaceid-soricid minimum bounds that the interordinal divergences are pushed far older (Fig. 3b).
We compared the specified soft bounds, joint marginal priors and posterior estimates for the above-noted key nodes (Fig. 4). The posterior 95% CIs fit better with our preferred dR40 calibrations (above: orange marginal prior, purple/brown posterior CIs) than with the dR40Springer calibrations (below: grey marginal prior, green/black posterior CIs). For all of these key calibrations our dR40 posterior CIs fell within or largely overlap the joint marginal prior. Whereas, with Springer et al.’s [10] calibrations, the posterior CI for either the independent or autocorrelated rates analysis falls fully outside both the specifed and marginal priors for Primates, Rodentia, Lagomorpha, Lorisiformes, and almost for Emballonuroidea. The lorisiform mismatch is extreme, being far younger than Springer et al.’s [10] Saharagalago reference fossil, which in turn, induces an anomalous 4.69-fold rate deceleration for this clade (see Additional file 2).

Comparison of the dR40 and dR40Springer calibration bounds, joint marginal priors, and posterior divergence estimates for seven key clades. For each clade the calibration bounds and 95% CIs for marginal priors and posterior estimates are shown (above) for our preferred dR40 calibration set, and (below) for the dR40Springer calibration set with calibration bounds substituted in from Springer et al. [10]. Posterior estimates are shown separately for the autocorrelated and independent rates models, however, the marginal priors under these two rates models are effectively the same, and here for clarity we average over the slight, primarily stochastic differences between them. (marginal priors and posterior estimates are provided in Additional file 2). Erinaceidae-Soricidae is further discussed in Additional file 1 (“Incorrect or poorly supported fossil placements”, 7)
Full size image
One recent genome-scale inference of mammal divergence [17] is remarkably sensitive to rate model assumptions, such that their results are difficult to place on Fig. 1. Even for their favoured STAR tree and gene-wise partitioning for MCMCtree, the primary interordinal diversification midpoint varies from 68.0 Ma with independent rates to 94.7 Ma with autocorrelated rates. Further substantial dating differences across partitioning schemes might also raise possible concerns about the underlying data (also see [49]), but two other issues are worth considering within our present context. Liu et al. [17] calibrate several very large, long-lived mammal clades, and 16 of 19 maximum bounds were defined by the presence of a stem lineage taxon (often the oldest, and with variously putative to well-agreed support). Maximum bounds should never be based on a specific fossil taxon – a practice that cannot account for sampling artefacts, and yet, when there is a good fossil record, can depend less on the age of the crown group being calibrated and more on the divergence from its sister taxon.
We employed Liu et al.’s [17] genomic data with our dR40 calibration scheme on the relevant nodes after deleting the large, long-lived taxa. The resulting timetrees (Additional file 2) provide far closer agreement between independent and autocorrelated rates models. Liu et al. [17] favoured the independent rates model over autocorrelated rates, based on several simulated and empirical tests. Under the independent rates model the placental diversification midpoint is 63.2 Ma, and the initial divergences within Laurasiatheria, Euarchontoglires and Afrotheria closely co-occur (all within 2.3 Ma) instead of being spread over 7.6 Ma as in Liu et al. [17]. Hence, with more rigorous calibration and reducing the potential for error-shift inflation, genome-scale data support the soft explosive model of placental evolution.
Molecular rates and life history traits among early placental mammals
Focusing calibration on clades that maintain ancestral evolutionary rates (or life history rate correlates) is the critical element shared by our most accurate dates for the simulated data and our empirical estimates for a placental origin younger than 80 Ma and major diversification near the 66 Ma KPg event (Fig. 2). This finding was foreshadowed by Phillips [11] showing that molecular rates for placental, marsupial and monotreme stem lineages were reliably traced back into the Mesozoic when calibrating clades that retain inferred ancestral life history traits, whereas calibrating only among large, long-lived mammals resulted in implausibly old divergences.
Inference of life history rate correlates from fossils also predicts that early eutherians had at least moderate rates of molecular evolution. All of the thousands of eutherian fossils from the period (Albian-Campanian: 113–72.1 Ma) that covers nearly all molecular date estimates for the origin and subsequent interordinal diversification of placentals were from small animals (< 250 g adult body mass) [50, 51]. Lifespans of these extinct eutherians were also likely to have been relatively short, because maximum longevity among all similarly small modern, non-volant and non-fossorial placentals is less than 20 years (mean 7.2 years; 95% CI 2.7–17.9 years, AnAge Database [52]).
One molecular argument against short longevity and high molecular rates among early placentals needs to be addressed. Romiguier et al. [18] analysed genomic protein coding GC content at 3rd positions (GC3) and found a remarkable correlation between GC3 conservation and longevity. They estimated maximum longevity of 25.7–40.9 years for early placentals, which is well beyond the range noted above for modern eutherians that are as small as their Albian-Campanian counterparts. However, Romiguier et al.’s [18] GC3 conservation metric is a function of time since divergence, and they assumed that crown placentals originated at 105 Ma.
Romiguier et al. [18] presented a time-correlated index of GC3 conservation, γ = −t/log(τ), where t is time since divergence and τ is Kendall’s correlation coefficient for GC3 conservation among genes, between species. We recalculated γ for each of Romiguier et al.’s [18] GC3 conservation coefficients (τ) for taxon pairs, but with divergence estimates from Phillips [11]. We confirm the strong correlation between γ and maximum longevity (R2 = 0.91; maximum longevity = 0.0683γ – 10.243). This relationship allows divergence estimates for the origin of placental mammals to be cross validated against life history inferences drawn from the fossil record. If we use our mean 77 Ma estimate for the placental origin from the dR32/dR40 analyses, the maximum longevity estimate for early placentals falls dramatically, to 7.9–21.9 years (Additional file 4), and is now consistent with many modern, small placentals. Thus, the emerging picture is of placental mammals with size and longevity similar to tree shrews, inheriting the post-KPg world and rapidly diversifying into the ecospace opened up by the extinction of dinosaurs and many other land vertebrates.
Molecular dating adaptive radiations
O’Leary et al. [5] argue for both the origin and major diversification of crown placentals at the KPg, but they did not account for fossil sampling errors. Unlike for some divergences within or between placental orders, unambiguous apomorphies for the placental crown are unclear, and biogeography reconstructions [6] give substantial probability to their origins being outside well-sampled Cretaceous mammal fossil faunas (e.g. in Africa). So we should not expect a close match between molecular estimates for the placental crown age and their earliest fossil records. Yet, the KPg molecular evolutionary rate spike that Springer et al. [29] claim for explosive models was produced by forcing this “hard” explosive model, which compresses the placental origin and > 15 Ma of evolution on our “soft” explosive tree (Fig. 3a) into just 200,000 years – an extreme scenario that they dismissed (but see [53]). In contrast, our “soft” explosive model places the placental origin at ~ 76–81 Ma and the subsequent interordinal diversification (not the placental origin) near the KPg, and molecular rate estimates for placentals remain much the same across the KPg [11]. However, parallel rate slowdowns occur in large-bodied, long-lived clades, such as whales and seacows [11], which upon calibration provide strong upwards pressure on interordinal divergences. Similar rate-shift inflation may be promoted in birds by parallel rate slowdowns, for example, among penguins and tubenoses [54].
We expect that the three key elements of error-shift inflation will often be associated with adaptive radiations. The first is that evolutionary races into novel ecospaces, which involve negotiating complex fitness landscapes, will favour species with large effective population sizes and high substitution rates [55,56,57], and these will typically be smaller, shorter-lived species. Much the same is predicted by theory around Cope’s rule [58, 59] for the tendency for radiations to proceed from smaller to larger body size. The second element, is that once large body size does evolve, fossil sampling improves [60] and allometry drives apomorphy [61]. These factors tend to promote tighter minimum bounds, which combined with the rate deceleration concomitant with large body size, provides the basis for error-shift inflation. The third factor that is typical for adaptive radiations is that maximum bounds are often necessarily conservative for calibrations deeper in the tree, if they rely on detecting smaller, more plesiomorphic taxa. This in turn reduces the effectiveness of these maximum bounds for buffering against error-shift inflation associated with underestimation of parallel rate deceleration among large, long-lived taxa.
Conclusions
In the present study our simulations based on empirical rate variation show that error-shift inflation associated with parallel rate deceleration among large, long-lived placentals can explain the proposed overestimation of interordinal divergences among molecular dating analyses. We have overcome error-shift inflation by focusing taxon sampling (or calibration) on mammals with more plesiomorphic life history rate-correlates, and by reducing asymmetrical confidence in assigning minimum and maximum calibration bounds. As a result, the most profound diversification event in placental mammal history is brought into temporal agreement between molecular dates and the fossil record (Fig. 1). A similar soft explosive model of diversification immediately following the KPg is now emerging among birds, within both Neoaves [19, 54, 62] and palaeognaths [63]. Better understanding the relationship between natural history rate-correlates and calibration strategies may be important for resolving molecular dating/fossil record controversies for other adaptive radiations, such as for the Cambrian explosion of metazoans, and for flowering plants.
Methods
Simulating molecular rate evolution and error-shift inflation among placental mammals
We simulated mammalian molecular data to understand whether realistic patterns of molecular rate variation, including parallel rate decelerations among large, long-lived taxa could explain interordinal divergence overestimates, when controlling for calibration. For each set of simulations we used Seq-Gen 1.3.3 [64] to generate 100 datasets of 20,000 bp sequences for a 12-taxon phylogeny (Fig. 2a) that is simplified from the proposed mammalian timetree of Phillips [11]. In addition to “monotreme” and “marsupial” outgroups, the “placental” ingroup has its crown origin at 80 Ma, with two daughter nodes at 66 Ma (mimicking superordinal divergences, such as Laurasiatheria and Afrotheria), and each splitting into two 33 Ma clades.
In the first set of simulations, which we refer to as “ancestral rates”, the branch rates are randomly drawn from a lognormal distribution (ln mean − 6.523, s.d. 0.274) modelled on inferred rates for small to mid-sized mammals (< 30 kg adult body mass, < 40 years maximum longevity) from [11], based on the 26-gene, 169-taxon dataset of Meredith et al. [2]. A second set of simulations that we refer to as “mixed rates” draws from the “ancestral rates” distribution for most of the tree, but mimics large, long-lived taxa for two 33 Ma clades diverging from nodes I and III in Fig. 2. These rates are drawn from the same lognormal distribution, but scaled to 1/5, similar to whales or seacows, from Phillips [11].
Timetrees for each simulated dataset were inferred separately in MCMCtree [25, 26], using the independent rates model. Calibrations were all symmetric, with 2.5% soft bound minima and maxima equidistant from the “true” simulated age. These age bounds are shown in Fig. 2b for all calibrated nodes. The simulated datasets were analysed either with all six calibrations (full calibration) or without calibrating the two clades (I & III) that exhibit the rate deceleration (ancestral rate nodes calibration).
Empirical data and deleting large, long-lived taxa
Mammalian timetrees were estimated from two DNA datasets based on the 26-gene (35,603 bp), 169-taxon alignment of Meredith et al. [2]. The first is the 122-taxon dataset, for which Springer et al. [10] had deleted all taxa included by Meredith et al. [2] that are > 10 kg and/or > 40 years maximum longevity. The second dataset (128 taxa) includes additional mammals up to 30 kg, to test the sensitivity of the date estimates to including medium sized mammals well outside the upper size bound of any Mesozoic eutherians, but that are not especially long lived (still < 40 years maximum longevity). In addition, we estimated timetrees from Liu et al.’s [17] three favoured “first quintile” 200-gene alignments, again including only the 57 taxa that are < 10 kg and < 40 years maximum longevity.
The fossil calibration bounds employed for each of the empirical timetree analyses are provided in Additional file 3, and joint marginal priors are provided in Additional file 2. To summarize, our initial analysis of the dataset for 122 taxa with presumed plesiomorphic life histories employs the calibration scheme of Phillips [11], except for calibrations on nodes deleted by Springer et al. [10]. Most placental mammal calibrations were originally based on [12]. Next we added eight additional, well-supported calibrations, including from among those that Springer et al. [10] implied would increase our divergence estimates, lifting the number of calibrations to 40. A further three calibrations were added upon the inclusion of additional taxa up to 30 kg for the 128-taxon dataset. Twenty-four of our favoured calibrations were compatible with the taxon sampling for the alignments derived from Liu et al. [17].
Geomolecular dating with MCMCtree
All timetrees based on empirical and simulated data were inferred with MCMCtree, within PAML [28]. Both the independent rates and autocorrelated rates models were employed for the 122-taxon and 128-taxon empirical datasets, with control-file priors and run parameters replicating Springer et al. [10]. This includes unit time (100 Ma), the rate prior parameters, rgene_gamma shape (1) and scale (5.41), and the rate drift prior parameters, sigma_gamma shape (1) and scale (4.207). Analyses were run for 200,000 generations, sampled every 50th generation, and a burnin of 10,000 generations was discarded. The 57-taxon alignments were similarly run in MCMCtree, although matching the original priors used by Liu et al. [17], including root age (4.16–4.254 Ma) and rgene_gamma (2, 40).
Rate distributions for the simulated datasets were based on the empirical data of Meredith et al. [2], with rate estimates taken from Phillips (Figure five in [11]; also see “Results and Discussion”). In the case of the “ancestral rates” simulations, rates were modelled only from branches representing mammals < 30 kg adult body mass and < 40 years maximum longevity. Given the rate estimate for these data of 0.1469 subs per 100 Ma, the rgene_gamma scale parameter was adjusted to 6.81 (=1/0.1469). The “mixed rates” analyses include four 33 Ma branches with 1/5 the ancestral rate, and as such the rgene_gamma scale parameter was adjusted to 7.51. The root age prior for all analyses of simulated data was 200 Ma (with sigma_gamma scale 2.0), with the root being symmetrically calibrated with soft 2.5% prior minimum and maximum bounds from 180 to 220 Ma.
Eutherian mammal diversification in the fossil record
Direct reading of the eutherian fossil record implies an extraordinary diversification immediately following the 66 Ma KPg event [7, 8, 11]. However, Springer et al. [10] advocate other diversification spikes well before the KPg, during the Turonian (93.9–89.3 Ma) and Campanian (83.6–72.1 Ma). They also suggest another diversification spike after the KPg, during the Ypresian (56.0–47.8 Ma). However, it is important to consider fossil sampling. A stage with a short duration and poor sampling will artefactually appear to have few new species appearances, while the same actual diversification rate will result in many more new species appearances for a longer, and better sampled stage, especially if it follows a stage in which new appearances were masked by poor sampling.
We obtained fossil species richness and new appearance counts from The Paleobiology Database (accessed 29 March 2017). To help even out sampling potential we start with the critical (and well-sampled) Campanian, Maastrichtian and Paleocene, and then provide further time bins as individual or combined stages that sample at least 80 mammal species. Mammals overall provide a better indicator of sampling potential than eutherians, which are expected to have very low species richness close to their origin. Our strategy resulted in relatively even bin durations (average 8.78 Ma, s.d. 2.17 Ma, see Fig. 1, Additional file 5), except for the oldest bin, Albian-Cenomanian (19.1 Ma duration), which is outside the range of molecular and morphological predictions for the diversification spike. A second important factor that Springer et al. [10] did not consider for either fossil or molecular diversification analysis is the standing diversity base from which new fossil appearances derive, or from which new molecular lineages diverge, as is standard in lineage through time analysis (see [16, 65]).
Our metric for eutherian diversification is the number of new eutherian species appearances for the time bin, divided by both the duration of the time bin and the standing diversity of eutherians in the previous time bin. Fossil sampling potential is still unlikely to be constant across all of the time bins. Therefore, to integrate out much of the sampling disparity we also show new eutherian appearances in each bin as a proportion of new appearances among all mammals (indicated by colour scaling in Fig. 1, also see Additional file 5).
Abbreviations
- CI:
-
Credible interval
- KPg:
-
Cretaceous-Paleogene boundary
- Ma:
-
Mega-anna (millions of years)
References
-
Bininda-Emonds ORP, Cardillo M, Jones KE, MacPhee RDE, Beck RMD, Grenyer R, Price SA, Vos RA, Gittleman JL, Purvis A. The delayed rise of present-day mammals. Nature. 2007;446(7135):507–12.
Article
PubMed
CASGoogle Scholar
-
Meredith RW, Janečka JE, Gatesy J, Ryder OA, Fisher CA, Teeling EC, Goodbla A, Eizirik E, Simão TLL, Stadler T, et al. Impacts of the cretaceous terrestrial revolution and KPg extinction on mammal diversification. Science. 2011;334(6055):521–4.
Article
PubMed
CASGoogle Scholar
-
Tarver JE, dos Reis M, Mirarab S, Moran RJ, Parker S, O’Reilly JE, King BL, O’Connell MJ, Asher RJ, Warnow T, et al. The interrelationships of placental mammals and the limits of phylogenetic inference. Genome Biol Evol. 2016;8(2):330–44.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Wible JR, Rougier GW, Novacek MJ, Asher RJ. The eutherian mammal Maelestes gobiensis from the late cretaceous of Mongolia and the phylogeny of cretaceous Eutheria. Bull Am Mus Nat Hist. 2009;316:1–123.
Article
Google Scholar
-
O’Leary MA, Bloch JI, Flynn JJ, Gaudin TJ, Giallombardo A, Giannini NP, Goldberg SL, Kraatz BP, Luo ZX, Meng J, et al. The placental mammal ancestor and the post-K-Pg radiation of placentals. Science. 2013;339(6120):662–7.
Article
PubMed
CASGoogle Scholar
-
Springer MS, Meredith RW, Janecka JE, Murphy WJ. The historical biogeography of Mammalia. Phil Trans Roy Soc B. 2011;366(1577):2478–502.
Article
Google Scholar
-
Alroy J. The fossil record of north American mammals: evidence for a Paleocene evolutionary radiation. Syst Biol. 1999;48(1):107–18.
Article
PubMed
CASGoogle Scholar
-
Longrich NR, Scriberas J, Wills MA. Severe extinction and rapid recovery of mammals across the cretaceous–Palaeogene boundary, and the effects of rarity on patterns of extinction and recovery. J Evol Biol. 2016;29(8):1495–512.
Article
PubMed
CASGoogle Scholar
-
Bininda-Emonds ORP, Purvis A. Comment on “impacts of the cretaceous terrestrial revolution and KPg extinction on mammal diversification”. Science. 2012;337(6090):34.
Article
PubMed
CASGoogle Scholar
-
Springer MS, Emerling CA, Meredith RW, Janečka JE, Eizirik E, Murphy WJ. Waking the undead: implications of a soft explosive model for the timing of placental mammal diversification. Mol Phylogenet Evol. 2017;106:86–102.
Article
PubMedGoogle Scholar
-
Phillips MJ. Geomolecular dating and the origin of placental mammals. Syst Biol. 2016;65(3):546–57.
Article
PubMedGoogle Scholar
-
dos Reis M, Inoue J, Hasegawa M, Asher RJ, Donoghue PCJ, Yang Z. Phylogenomic datasets provide both precision and accuracy in estimating the timescale of placental mammal phylogeny. Proc Roy Soc B. 2012;279(1742):3491–500.
Article
Google Scholar
-
Parham JF, Donoghue PCJ, Bell CJ, Calway TD, Head JJ, Holroyd PA, Inoue JG, Irmis RB, Joyce WG, Ksepka DT, et al. Best practices for justifying fossil calibrations. Syst Biol. 2012;61(2):346–59.
Article
PubMedGoogle Scholar
-
Benton MJ. Early origins of modern birds and mammals: molecules vs. morphology. Bioessays. 1999;21(12):1043–51.
Article
PubMed
CASGoogle Scholar
-
Simpson GG. The principles of classification and a classification of mammals. Bull Am Mus Nat Hist. 1945;85:1–307.
Google Scholar
-
Foote M, Hunter JP, Janis CM, Sepkoski JJ. Evolutionary and preservational constraints on origins of biologic groups: divergence times of eutherian mammals. Science. 1999;283(5406):1310–4.
Article
PubMed
CASGoogle Scholar
-
Liu L, Zhang J, Rheindt FE, Lei FM, Qu YH, Wang Y, Zhang Y, Sullivan C, Nie WH, Wang JH, et al. Genomic evidence reveals a radiation of placental mammals uninterrupted by the KPg boundary. Proc Natl Acad Sci U S A. 2017;114(35):E7282–90.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Romiguier J, Ranwez V, Douzery EJP, Galtier N. Genomic evidence for large, long-lived ancestors to placental mammals. Mol Biol Evol. 2013;30(1):5–13.
Article
PubMed
CASGoogle Scholar
-
Jarvis ED, Mirarab S, Aberer AJ, Li B, Houde P, Li C, Ho SYW, Faircloth BC, Nabholz B, Howard JT, et al. Whole-genome analyses resolve early branches in the tree of life of modern birds. Science. 2014;346(6215):1320–31.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Mitchell KJ, Cooper A, Phillips MJ. Comment on “whole-genome analyses resolve early branches in the tree of life of modern birds”. Science. 2015;349(6255):1460.
Article
PubMed
CASGoogle Scholar
-
Beaulieu JM, O’Meara BC, Crane P, Donoghue MJ. Heterogeneous rates of molecular evolution and diversification could explain the Triassic age estimate for angiosperms. Syst Biol. 2015;64(5):869–78.
Article
PubMed
CASGoogle Scholar
-
Brown JW, Smith SA. The past sure is tense: on interpreting phylogenetic divergence time estimates. Syst Biol. 2018;67:340–53.
Article
PubMedGoogle Scholar
-
Foster CSP, Sauquet H, Van der Merwe M, McPherson H, Rossetto M, Ho SYW. Evaluating the impact of genomic data and priors on Bayesian estimates of the angiosperm evolutionary timescale. Syst Biol. 2017;66(3):338–51.
PubMed
Google Scholar
-
Lee MSY, Soubrier J, Edgecombe GD. Rates of phenotypic and genomic evolution during the Cambrian explosion. Curr Biol. 2013;23(19):1889–95.
Article
PubMed
CASGoogle Scholar
-
Yang Z. PAML 4: phylogenetic analysis by maximum likelihood. Mol Biol Evol. 2007;24(8):1586–91.
Article
PubMed
CASGoogle Scholar
-
Yang Z, Rannala B. Bayesian estimation of species divergence times under a molecular clock using multiple fossil calibrations with soft bounds. Mol Biol Evol. 2006;23(1):212–26.
Article
PubMed
CASGoogle Scholar
-
Lane A, Janis CM, Sepkoski JJ. Estimating paleodiversities: a test of the taxic and phylogenetic methods. Paleobiology. 2005;31(1):21–34.
Article
Google Scholar
-
Springer MS, Burk-Herrick A, Meredith R, Eizirik E, Teeling E, O’Brien SJ, Murphy WJ. The adequacy of morphology for reconstructing the early history of placental mammals. Syst Biol. 2007;56(4):673–84.
Article
PubMedGoogle Scholar
-
Springer MS, Meredith RW, Teeling EC, Murphy WJ. Technical comment on “the placental mammal ancestor and the post-K-Pg radiation of placentals”. Science. 2013;341(6146):613.
Article
PubMed
CASGoogle Scholar
-
Herrera JP, Dávalos LM. Phylogeny and divergence times of lemurs inferred with recent and ancient fossils in the tree. Syst Biol. 2016;65(5):772–91.
Article
PubMedGoogle Scholar
-
Marivaux L, Ramdarshan A, Essid EM, Marzougui W, Ammar HK, Lebrun R, Marandat B, Merzeraud G, Tabuce R, Vianey-Liaud M. Djebelemur, a tiny pre-tooth-combed primate from the Eocene of Tunisia: a glimpse into the origin of crown strepsirhines. PLoS One. 2013;8(12):e80778.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Rose KD, DeLeon VB, Missiaen P, Rana RS, Sahni A, Singh L, Smith T. Early Eocene lagomorph (Mammalia) from western India and the early diversification of Lagomorpha. Proc Roy Soc B. 2008;275(1639):1203–8.
Article
Google Scholar
-
Matthee CA, van Vuuren BJ, Bell D, Robinson TJ. A molecular supermatrix of the rabbits and hares (Leporidae) allows for the identification of five intercontinental exchanges during the Miocene. Syst Biol. 2004;53(3):433–47.
Article
PubMedGoogle Scholar
-
Zhang Z, Li C, Wang J. Presence of the calcaneal canal in basal Glires. Vertebrata PalAsiatica. 2016;54(3):235–42.
Google Scholar
-
Storch G, Sigé B, Habersetzer J. Tachypteron franzeni n. Gen., n. Sp., earliest emballonurid bat from the middle Eocene of Messel (Mammalia, Chiroptera). Paläontol Z. 2002;76(2):189–99.
Article
Google Scholar
-
Teeling EC, Springer MS, Madsen O, Bates P, Brien SJ, Murphy WJ. A molecular phylogeny for bats illuminates biogeography and the fossil record. Science. 2005;307:580–4.
Article
PubMed
CASGoogle Scholar
-
Maitre E, Sigé B, Escarguel G. A new family of bats in the Paleogene of Europe: systematics and implications for the origin of emballonurids and rhinolophoids. Neues Jahrbuch fur Geologie und Palaontologie-Abhandlungen. 2008;250(2):199–216.
Article
Google Scholar
-
Ravel A, Adaci M, Bensalah M, Charruault A-L, Essid EM, Ammar HK, Marzougui W, Mahboubi M, Mebrouk F, Merzeraud G, et al. Origine et radiation initiale des chauves-souris modernes: nouvelles découvertes dans l’Éocène d’Afrique du Nord. Geodiversitas. 2016;38(3):355–434.
Article
Google Scholar
-
Brown TM, Schankler D. A review of the Proteutheria and Insectivora of the Willwood formation (lower Eocene) Bighorn Basin, Wyoming. U S Geol Surv Bull. 1982;1523:1–79.
Google Scholar
-
Novacek MJ, Bown TM, Schankler DM. On the classification of early tertiary Erinaceomorpha (Insectivora, Mammalia). Am Mus Novit. 1985;2813:1–22.
Google Scholar
-
Hooker JJ, Russell DE. Early Palaeogene Louisinidae (Macroscelidea, Mammalia), their relationships and north European diversity. Zool J Linnean Soc. 2012;164(4):856–936.
Article
Google Scholar
-
Secord R. The Tiffanian land-mammal age (middle and late Paleocene) in the northern Bighorn Basin, Wyoming. Univ Mich Pap Paleontology. 2008;35:1–192.
Google Scholar
-
Barnett R, Barnes I, Phillips MJ, Larry D, Martin C, Leonard JA, Cooper A. Evolution of the extinct sabretooths and the American cheetah-like cat. Proc Natl Acad Sci U S A. 2005;101:1626–31.
Google Scholar
-
Phillips MJ. Four mammal fossil calibrations: balancing competing palaeontological and molecular considerations. Palaeontol Electron. 2015;18(1):1–16.
Google Scholar
-
Benton MJ, Donoghue PC, Asher RJ, Friedman M, Near TJ, Vinther J. Constraints on the timescale of animal evolutionary history. Palaeontol Electron. 2015;18(1):1–106.
Google Scholar
-
Emerling CA, Huynh HT, Nguyen MA, Meredith RW, Springer MS. Spectral shifts of mammalian ultraviolet-sensitive pigments (short wavelength-sensitive opsin 1) are associated with eye length and photic niche evolution. Proc Roy Soc B. 2015;282:2015817.
Article
CASGoogle Scholar
-
Halliday TJD, Upchurch P, Goswami A. Eutherians experienced elevated evolutionary rates in the immediate aftermath of the cretaceous — Palaeogene mass extinction. Proc Roy Soc B. 2016;283:20153026.
Article
CASGoogle Scholar
-
Ronquist F, Lartillot N, Phillips MJ. Closing the gap between rocks and clocks using total-evidence dating. Phil Trans Roy Soc B. 2016;371:20150136.
Article
Google Scholar
-
Gatesy J, Springer MS. Phylogenomic red flags: homology errors and zombie lineages in the evolutionary diversification of placental mammals. Proc Natl Acad Sci U S A. 2017;114:E9431–2.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Slater GJ. Phylogenetic evidence for a shift in the mode of mammalian body size evolution at the cretaceous-Palaeogene boundary. Methods Ecol Evol. 2013;4(8):734–44.
Article
Google Scholar
-
Halliday TJD, Goswami A. The impact of phylogenetic dating method on interpreting trait evolution: a case study of cretaceous–Palaeogene eutherian body-size evolution. Biol Lett. 2016;12:20160051.
Article
PubMed
PubMed CentralGoogle Scholar
-
de Magalhaes JP, Costa J. A database of vertebrate longevity records and their relation to other life-history traits. J Evol Biol. 2009;22(8):1770–4.
Article
PubMed
CASGoogle Scholar
-
Beck RMD, Lee MSY. Ancient dates or accelerated rates? Morphological clocks and the antiquity of placental mammals. Proc Roy Soc B. 2014;281:20141278.
Article
Google Scholar
-
Ksepka DT, Phillips MJ. Avian diversification patterns across the K-Pg boundary: influence of calibrations, datasets, and model misspecification. Ann Mo Bot Gard. 2015;100:300–28.
Article
Google Scholar
-
Gavrilets S, Vose A. Dynamic patterns of adaptive radiation. Proc Natl Acad Sci U S A. 2005;102:18040–5.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Charlesworth B. Effective population size and patterns of molecular evolution and variation. Nat Rev Genet. 2009;10:195–205.
Article
PubMed
CASGoogle Scholar
-
Lynch M, Abegg A. The rate of establishment of complex adaptations. Mol Biol Evol. 2010;27(6):1404–14.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Rensch B. Histological changes correlated with evolutionary changes of body size. Evolution. 1948;2(3):218–30.
Article
PubMed
CASGoogle Scholar
-
Polly PD. Cope’s rule. Science. 1998;282(5386):47.
Article
Google Scholar
-
Kidwell SM, Flessa KW. The quality of the fossil record: populations, species, and communities. Annu Rev Ecol Syst. 1995;26(1):269–99.
Article
Google Scholar
-
Marroig G, Cheverud JM. Size as a line of least evolutionary resistance: diet and adaptive morphological radiation in new world monkeys. Evolution. 2005;59(5):1128–42.
Article
PubMedGoogle Scholar
-
Prum RO, Berv JS, Dornburg A, Field DJ, Townsend JP, Lemmon EM, Lemmon AR. A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 2015;526(7574):569–73.
Article
PubMed
CASGoogle Scholar
-
Grealy A, Phillips M, Miller G, Gilbert MT, Rouillard JM, Lambert D, Bunce M, Haile J. Eggshell palaeogenomics: Palaeognath evolutionary history revealed through ancient nuclear and mitochondrial DNA from Madagascan elephant bird (Aepyornis sp.) eggshell. Mol Phylogenet Evol. 2017;109:151–63.
Article
PubMed
CASGoogle Scholar
-
Rambaut A, Grassly NC. Seq-gen: an application for the Monte Carlo simulation of DNA sequence evolution along phylogenetic trees. Bioinformatics. 1997;13(3):235–8.
Article
CASGoogle Scholar
-
Rabosky DL. Likelihood methods for detecting temporal shifts in diversification rates. Evolution. 2006;60(6):1152–64.
Article
PubMedGoogle Scholar
-
Lartillot N, Phillips MJ, Ronquist F. A mixed relaxed clock model. Phil Trans Roy Soc B. 2016;371:20150132.
Article
Google Scholar
-
Murphy WJ, Pringle TH, Crider TA, Springer MS, Miller W. Using genomic data to unravel the root of the placental mammal phylogeny. Genome Res. 2007;17(4):413–21.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Springer MS, Murphy WJ, Eizirik E, O’Brien SJ. Placental mammal diversification and the cretaceous–tertiary boundary. Proc Natl Acad Sci U S A. 2003;100(3):1056–61.
Article
PubMed
PubMed Central
CASGoogle Scholar
-
Kumar S, Stecher G, Suleski M, Hedges SB. TimeTree: a resource for timelines, timetrees, and divergence times. Mol Biol Evol. 2017;34(7):1812–9.
Article
PubMedGoogle Scholar
Download references
Acknowledgements
We are grateful to David Penny and Peter Waddell for valuable discussions on mammalian diversification and to Robin Beck for helpful comments on the manuscript. Thomas Halliday kindly provided dated morphological trees, and Adam Stone assisted with QUT High Performance Computing. Three anonymous reviewers provided valuable comments that improved the manuscript.
Funding
This research was funded by an Australian Research Council Discovery grant (DP150104659 to MJP).
Availability of data and materials
All data analysed during this study are included in this published article and its supplementary information files, or appropriately cited and publically available from earlier studies.
Author information
Authors and Affiliations
-
School of Earth, Environmental and Biological Sciences, Queensland University of Technology, Brisbane, Australia
Matthew J. Phillips & Carmelo Fruciano
Authors
- Matthew J. Phillips
You can also search for this author in
PubMed Google Scholar - Carmelo Fruciano
You can also search for this author in
PubMed Google Scholar
Contributions
MJP designed the study, curated the fossil calibrations, simulated DNA data, ran the fossil record and longevity analyses, and wrote the manuscript. CF ran the MCMCtree analyses and collated published molecular dates. Both authors read and approved the final manuscript.
Corresponding author
Correspondence to
Matthew J. Phillips.
Ethics declarations
Ethics approval and consent to participate
Not applicable.
Consent for publication
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Additional files
Additional file1:
Addressing claims of “zombie” lineages on Phillips’ (2016) timetree. Table S1. and Figure S1. (PDF 588 kb)
Additional file 2:
MCMCtree timetrees. Table S2. Figure S2. and Figure S3. (PDF 525 kb)
Additional file 3:
Fossil calibration schemes. Table S3. and Figure S4. (PDF 583 kb)
Additional file 4:
GC3 conservation and estimating maximum longevity. Figure S5. (PDF 251 kb)
Additional file 5:
Table S4. Fossil record species richness for Eutheria and Mammalia from Albian through to Lutetian. (PDF 90 kb)
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Phillips, M.J., Fruciano, C. The soft explosive model of placental mammal evolution.
BMC Evol Biol 18, 104 (2018). https://doi.org/10.1186/s12862-018-1218-x
Download citation
-
Received: 17 October 2017
-
Accepted: 19 June 2018
-
Published: 03 July 2018
-
DOI: https://doi.org/10.1186/s12862-018-1218-x
Keywords
- Cretaceous-Paleogene boundary
- Fossil calibration
- Life history
- Molecular dating
- Placentalia
Получена наиболее полная картина эволюции современных плацентарных, позволившая реконструировать общего предка этой группы, который, вопреки существовавшим представлениям, не застал эпоху динозавров.
Большая группа исследователей, работавшая в рамках международной научной программы по реконструкции древа жизни ATOL (Assembling the Tree of Life), реконструировала общего предка и построила наиболее полную картину эволюции плацентарных — самой распространенной и самой высокоразвитой группы млекопитающих животных, отличающейся также огромным видовым разнообразием (в настоящее время к плацентарным принадлежат более пяти тысяч видов млекопитающих, в том числе приматы и человек). Полученные результаты вносят ясность в историю происхождения и адаптации этой группы живых существ к изменявшимся условиям окружающей среды (в том числе климатическим), а также помогут понять, как плацентарные будут эволюционировать в дальнейшем.
<2>В большой итоговой статье, опубликованной в ночь на пятницу в Science, уточняется и временной рубеж, когда в группе древних плацентарных выделилась линия, ставшая предковой для всех современных представителей этой группы.
Вопреки существующим представлениям, общий предок современных плацентарных не был современником динозавров
и жил после мел-палеогенового вымирания — одного из пяти великих массовых вымираний, случившегося 65 млн лет назад.
Большая эволюционная ветвь, занимаемая плацентарными, была детально реконструирована на основе анализа и сопоставления огромного массива данных двух типов — молекулярных (генетического кода ДНК) и анатомических, которые охватывают несколько тысяч морфологических признаков, отличающих (или когда-то отличавших) одну разновидность плацентарных от другой. Сведением этих данных воедино и построением итоговой эволюционной матрицы занималось две команды — генетики и специалисты по таксономии (систематической классификации) плацентарных.
«В области исследований млекопитающих существовало сильное разделение между теми, кто изучает ДНК, и теми, кто изучает морфологию. До этого проекта у них просто не было возможности поработать вместе по-настоящему», — объясняет преимущества работы в ATOL один из авторов статьи палеонтолог Джон Уибл, куратор отдела млекопитающих музея естественной истории Карнеги.
Поскольку ДНК со временем деградирует, источником данных по генетической эволюции плацентарных стали расшифрованные ДНК современных представителей этой группы, а также некоторые реконструированные последовательности ископаемых ДНК не старше 30 тысяч лет. В свою очередь, база данных по морфологии охватывала 86 видов плацентарных (включая 40 вымерших) и 4500 анатомических признаков, характеризующих эти виды (вплоть до таких детальных, как окраска шерсти, форма клыков или особенности строения мозга), а для ее составления использовался MorphoBank, мощная облачная база данных по морфологии живых существ, регулярно пополняемая учеными всего мира.
В общей сложности число учтенных признаков (4500) почти на порядок превышало число признаков, на основе которых исследовались до этого родственные связи плацентарных (не более 500).
«Не сказать, что генетика и данные морфологии не комбинировались раньше, но на этот раз объем анализированной информации вырос просто феноменально», — признает один из участников исследования Мишель Сполдинг.
Благодаря такому объему данных, стало возможным более точно определить, когда жили, как эволюционировали и как могли выглядеть некоторые вымершие виды, какие анатомические признаки появлялись раньше, какие позже, а также установить примерное время, когда от эволюционного древа отделился общий предок всех современных плацентарных, и примерно реконструировать его внешний облик. Естественно, эта реконструкция, учитывающая предположительную массу тела, тип шерстяного покрова, число зубов и ряд других признаков, остается чисто гипотетической — ископаемых останков самых древних плацентарных насчитывается пока что очень мало, но реконструкция поможет их правильно интерпретировать.
Как бы то ни было, общим предком людей, китов и других млекопитающих, вынашивающих свое потомство внутри плаценты, был зубастый зверек с вытянутой мордой, короткой шерстью, длинным хвостом и размером с крысу.
Зверек питался насекомыми и жил спустя примерно 200–400 тысяч лет после события, известного как мел-палеогеновое вымирание, результатом которого было исчезновение с лица Земли 70% живых видов, в том числе динозавров.
Каким образом удается проследить историю эволюции живых существ до сотен миллионов лет назад, выясняя время появления и внешний вид организмов, которые были общими далекими предками современных животных, совершенно, на первый взгляд, друг на друга не похожих?
Делать это позволяют два массива данных. Один содержит подробные описания анатомического строения всех животных, в том числе и некоторых вымерших, позволящие объединять их в родственные группы по определенным физическим признакам. Второй представляет собой расшифрованные ДНК животных, в которых содержится передаваемая по наследству информация (гены), отвечающая за формирование этих признаков у организмов. Имея на руках расшифрованные геномы, можно определить как степень близости геномов различных видов, так и проследить историю их формирования, взяв за шкалу отсчета известную среднюю скорость накопления изменений (мутаций) в генах.
В принципе, одних данных генетики для построения эволюционных деревьев вполне достаточно, но на практике из-за разной скорости мутаций и некоторых других факторов, «хронология» таких деревьев может быть очень неточной. Наиболее оптимальным методом, позволяющим, двигаясь по такому дереву сверху вниз, выявлять общих предков, является комбинация данных генетики с максимально возможным числом выявленных физических признаков, отличающих один вид животных от другого.
<4>Так, в случае с плацентарными, новая, комбинирующая данные морфологии и генетики, датировка опровергла датировку, существовавшую до этого и полученную на основе лишь молекулярно-статистического анализа ДНК, и согласно которой предки современных плацентарных уже жили в среднем меле, застав эпоху динозавров в самом ее расцвете. Данные морфологии категорически этому противоречили, и разрешить конфликт теорий было одной из целей проекта ATOL.
<5>Сейчас картина прояснилась: по всей видимости, массовое вымирание на границе мела и палеогена стало эволюционной прелюдией последовавшего за этой катастрофой численного взрыва и роста видового разнообразия плацентарных, результатом которого стало и выделение предковой линии современных плацентарных.
Помимо этого, построенное филогенетическое дерево плацентарных поставило под вопрос и некоторые другие представления об эволюции этой группы. Так, выяснилось, что одна из ветвей плацентарных афротерии (которая называется так потому, что ее современные представители, к которым принадлежат слоны и трубкозубы, живут в Африке) происходит не с африканского континента, а из северной и южной Америки.
Также полученные данные противоречат еще одной теории, согласно которой видовое разделение плацентарных усилилось после разделения древнего суперконтинента Гондваны. На новом «дереве жизни», построенном с учетом большего числа данных, эти явления исторически никак не связаны.
Происхождение и эволюция млекопитающих
Последний этап
развития позвоночных животных связан
с формированием и расцветом млекопитающих.
За сравнительно короткое геологическое
время, примерно за 60 млн. лет, млекопитающие
достигли высокой ступени развития.
Предками
млекопитающих были примитивные
палеозойские рептилии,
еще не успевшие приобрести узкую
специализацию, столь характерную для
большинства последующих групп
пресмыкающихся. Таковы пермские
зверозубые из подкласса звероподобных.
Зубы у них были в альвеолах. Многие виды
имели вторичное костное небо. Квадратная
кость и сочленовная кость нижней челюсти
были сильно редуцированы: зубная кость,
наоборот, была развита очень сильно.
(Напомним, что у млекопитающих нижняя
челюсть состоит только из зубной кости).
Затылочный мыщелок был у некоторых
видов двойной.
Прогрессивная
эволюция млекопитающих была связана с
приобретением ими таких решающих
приспособлений, как постоянная
высокая
температура тела, способность к
терморегуляции, живородности
и главным образом высоко
развитая нервная система,
обеспечившая сложное поведение зверей
и разнообразные приспособительные
реакции их на воздействия окружающей
жизненной обстановки. Морфологически
это выражалось в разделении сердца на
четыре камеры и в сохранении при этом
одной (левой) дуги аорты, что обеспечивает
несмешиваемость артериальной и венозной
крови, в появлении вторичного костного
неба, обеспечивающего дыхание во время
еды, в преобразовании рогового покрова
тела в волосяной, защищающий организм
от потери тепла, в живорождении и
вскармливании детенышей молоком, в
появлении вторичного мозгового свода
и т. п.
Млекопитающие
появились, по-видимому, в триасе (таблица
1). В отложениях верхнего триаса (190-150
млн. лет назад) найдены своеобразные
многобугорчатые, получившие свое
название в связи с наличием на коренных
зубах многочисленных бугорков. Это была
специализированная группа животных с
очень сильно развитыми резцами и без
клыков. Многобугорчатые
представляли специализированных
растительноядных зверей, и их нельзя
считать предками последующих групп
млекопитающих. Можно лишь предположить,
что ранние их формы дали начало
однопроходным.
Зубы их весьма похожи на зубы зародыша
утконоса.
Для становления
нового класса – млекопитающие –
потребовалось много времени. На протяжении
двух третей своей геологической истории
млекопитающие оставались мелкими,
внешне они напоминали крысу, наиболее
крупные достигали размеров сурка. Они
не играли заметной роли в природе. Их
быстрый прогресс в кайнозое (60-1 млн.
лет), очевидно, был связан с последовательным
накоплением многих приспособлений,
приведших к теплокровности, живорождению
и выкармливанию детенышей молоком,
развитию органов чувств, центральной
нервной и гормональной систем.
Таблица 1
История планеты
Земля
|
Эры |
Периоды, |
Миллионов лет |
Развитие |
|
Архейская |
2100-1500 |
Простейшие |
|
|
Протерозойская |
1500-600 |
Беспозвоночные |
|
|
Палеозойская |
550-215 |
Беспозвоночные, |
|
|
Мезозойская |
Триасовый |
190-120 |
Земноводные, |
|
Юрский |
155-130 |
Появление |
|
|
Мел |
130-60 |
Появление |
|
|
Кайнозойская |
Третичный А) Эпохи: Эоцен Олигоцен |
60-1 60-28 60-52 52-35 35-28 |
Бурное Начало Предок Оленьки, |
|
Б) Эпохи: Плиоцен |
27-1 27-8 8-1 |
Гиппарионовая Волчьи, |
|
|
Четвертичный Эпохи: (ледниковая) Голоцен |
0,9-0,01 0,9-0,02 0,02 |
Перестройка Совершенствование |
Более близкие к
предполагаемым предкам современных
млекопитающих формы появились на Земле
в середине юрского периода (150-130 млн.
лет). Это так называемые трехбугорчатые.
Зубы их менее специализированы, чем у
многобугорчатых; зубной ряд сплошной.
Трехбугорчатые были маленькими зверьками,
питавшимися, очевидно, преимущественно
насекомыми, может быть, и другими мелкими
животными и яйцами рептилий. Биологически
они были в известной мере близки к
наземным и древесным насекомоядным.
Головной мозг их был мал, но все же
значительно больше, чем у зверозубых
рептилий. Основная группа трехбугорчатых
— пантотерии
— была исходной для сумчатых
и плацентарных.
Сумчатые
появляются в меловой период (130-60 млн.
лет). Наиболее ранние их находки приурочены
к отложениям нижнего мела Северной
Америки и нижнетретичным отложениям
Северной Америки и Евразии. Таким
образом, родиной сумчатых следует
считать Северное полушарие, где они
были широко распространены в начале
третичного периода (60-50 млн. лет). Еще до
конца этого времени здесь они были
вытеснены более высокоорганизованными
плацентарными и к современности
сохранились только в Австралии, Новой
Гвинее, Тасмании, Южной Америке, отчасти
в Северной Америке (1 вид) и на острове
Сулавеси (Целебес) (1 вид).
Наиболее древняя
группа сумчатых — это многорезцовые,
распространение которых в настоящее
время совпадает с распространением
всего инфракласса.
Двурезцовые
сумчатые — более поздняя группа, возникшая
в Австралии от древних многорезцовых
и никогда не выходившая в своем
распространении за пределы Австралийской
области. Австралия обособилась от других
участков суши, видимо, ранее того времени,
когда туда могли проникнуть плацентарные,
и на этом материке сумчатые образовали
наибольшее разнообразие форм зверей,
приспособившихся к существованию в
самой разнообразной жизненной обстановке.
В Южной Америке
сумчатые были относительно многочисленными
до середины третичного периода (30 млн.
лет), когда там не было плацентарных
копытных и хищных. После миоцена (27-8
млн. лет) сумчатые в Южной Америке были
почти полностью вытеснены плацентарными
и сохранились в числе немногих
специализированных видов.
Плацентарные
млекопитающие
возникли также в меловом периоде (130-60
млн. лет) и представляют самостоятельную,
в известной мере параллельную сумчатым
ветвь зверей. Наиболее древней группой
плацентарных является отряд насекомоядных.
Они были частью наземными, частью
древесными видами, давшими начало
большинству основных групп последующих
плацентарных. Древесные насекомоядные,
приспособившиеся к полету, дали начало
рукокрылым.
Ветвь, приспособившаяся к хищничеству,
дала в начале третичного периода (60-50
млн. лет) начало древним примитивным
хищникам —
креодонтам.
Они имели широкое распространение лишь
короткое время. Уже в конце олигоцена
(35-28 млн. лет), когда медлительные копытные
раннетретичного периода сменились
более подвижными, креодонты были
вытеснены их потомками — более
специализированными хищниками. От
хищников отделилась ветвь водных зверей
— ластоногих.
В олигоцене уже существовали предковые
группы ряда современных семейств хищных
(виверр,
куниц, собак, кошек).
От креодонтов
происходят и древние
копытные,
или кондилартры,
— мелкие звери величиной не более собаки,
которые были всеядными. Конечности их
были пятипалыми с несколько усиленным
третьим пальцем и укороченными первым
и пятым пальцами. Кондилартры
просуществовали недолго, и уже в начале
эоцена (52-35 млн. лет) от них возникли две
самостоятельные ветви: отряды
непарнокопытных
и парнокопытных.
В эоцене возникают хоботные.
В целом группа копытных имеет сборный
характер. Отдельные отряды копытных
произошли самостоятельно от
специализированных насекомоядных
или от ближайших потомков — креодонтов.
Внешнее сходство
между отдельными отрядами есть результат
приспособления к сходным условиям
жизни. Некоторые отряды вымерли в
третичное время. Такова, например, очень
своеобразная группа южноамериканских
копытных,
развившаяся на одноименном континенте
в период его изоляции от других материков,
давшая ряд параллельных с другими
копытными
ветвей. Здесь были звери, подобные по
своим приспособлениям лошадям,
носорогам, гиппопотамам.
Непосредственно
от насекомоядных в самом начале третичного
периода (60-50 млн. лет) возник ряд и других
отрядов. Таковы, например, неполнозубые,
грызуны,
приматы.
Ископаемые обезьяны
известны с палеогена. Древесные обезьяны
проплиопитекусы
дали начало
гиббонам и крупным, близким к антропоидам
рамапитекусам
из миоцена (27-8 млн. лет) Индии. Большой
интерес представляют найденные в
четвертичных отложениях Южной Африки
австралопитекус
и особенно высшие человекообразные
обезьяны – плезиантропус
и парантропус.
Первая из указанных обезьян жила в
открытых пространствах и ходила,
вероятно, на двух ногах. Рост ее был
около 120 см. Емкость черепа около 440 см3.
У второй емкость черепа была еще больше
— до 600 см3.
Обезьяны эти стоят близко к человеку,
и нет сомнения, что от какого-то вида
человекообразных обезьян, близких к
парантропусу и плезиантропусу, произошел
человек.
Разнообразные
адаптации млекопитающих способствовали
освоению не только суши, но также пресных
и морских водоемов, грунта, воздуха. Они
обеспечили необычайно широкое, по
сравнению с другими позвоночными,
использование пищевых ресурсов: спектр
питания млекопитающих разнообразнее
состава кормов других наземных и водных
позвоночных. Все это обусловило
доминирование млекопитающих в биосфере.
Соседние файлы в предмете Зоология
- #
- #
Основные понятия
К плацентарным млекопитающим относятся виды, которые имеют специальный орган — плаценту. Именно через нее в утробе матери сначала яйцеклетка, а затем и формирующийся плод получают все необходимые питательные вещества. Считается, что наличие плаценты — прогрессивная черта различных животных, что позволяет им иметь крайне сложное внутреннее строение с многочисленными органами. При этом на свет появляются уже сформированные детёныши, которые быстро развиваются и растут.
В систематике всех видов млекопитающих принято выделять 2 основных подкласса, к которым относятся первозвери и настоящие звери. Первая категория — яйцекладущие животные, в том числе ехидна и утконос. Учёные отмечают, что это переходный тип от простейших видов к сложным высокоорганизованным млекопитающим. Для настоящих зверей характерно живорождение и внутриутробное развитие. В этой большой группе принято различать низшие и плацентарные виды. К первым относятся сумчатые, у которых беременность проходит крайне быстро, а детеныш рождается недоразвитым.
Основные признаки плацентарных животных:
- наличие трёх видов зубов;
- формирование вокруг плода плаценты;
- постоянная высокая температура тела;
- развитые полушария переднего мозга;
- отсутствие сумчатых костей.
Именно наличие выраженного переднего мозга и отличает плацентарных животных от других видов. Кора полушарий может состоять из многих слоев клеток с четко выраженными центрами высшей нервной активности. Температура тела у плацентарных видов колеблется от 36,5 до 38 градусов, тогда как у сумчатых этот показатель составляет 34−35 градусов, у первозверей от 25 до 30 градусов тепла. Большинство рожает уже полностью сформированных детенышей, а у отдельных представителей они практически сразу имеют частичную самостоятельность.
Одной из особенностей плацентарных животных является наличие у них широких тазовых отверстий, что позволяет матери вынашивать крупноразмерных детёнышей. Это дает возможность рожать уже полностью сформированных крупных малышей, которые в скором времени становятся на ноги и быстро развиваются, получая вместе с материнским молоком большое количество легкоусваиваемого питательного белка.
Эволюционное развитие
После исчезновения динозавров, которые в конце мелового периода доминировали на планете, для небольших по своему размеру млекопитающих открылись новые экологические ниши и жизненные пространства. В это время уже отделились континенты, поэтому формирование видов происходило в определённой изоляции друг от друга. Известно, что в Австралии и Южной Америке доминировали сумчатые, а на других материках начали широко распространяться различные плацентарные животные.
Считается, что самым древним животным, у которого возникла плацентарность, можно назвать юрамайю, окаменелости которой были найдены в китайской провинции Ляонин в отложениях, относящихся к юрскому периоду. Именно в промежуток от 140 до 170 миллионов лет назад появилось разделение млекопитающих. Многие виды, у которых развитие плода происходило внутри утробы с использованием плаценты, получили возможность быстро размножаться и доминировать на планете.
В течение ближайших 50−70 миллионов лет появились разнообразные виды плацентарных млекопитающих, которые имели общее историческое происхождение и отличались своими отдельными генами. В зависимости от климата такие животные были как небольшими по размеру, так и огромными гигантами, в том числе слонами, гиппопотамами и носорогами с жирафами.
В отдельную группу относят человекоподобных обезьян и Homo Sapiens, которые благодаря развитой мозговой деятельности, не только научились создавать социум, но и мигрировали в другие, подходящие для жизни места.
Классификация животных
На сегодняшний день плацентарные виды являются самой разнообразной и распространённой среди всех млекопитающих. Ученые биологи выделяют 4 основных надотряда, которые отличаются от пресмыкающихся внешностью, особенностями строения и имеющимися генами. Характерной особенностью млекопитающих является живорождение и их особый онтогенез.
К этой группе млекопитающих относятся 18 больших отрядов. Животные характеризуются длительным периодом вынашивания детенышей: у слонов срок беременности может достигать почти 2 лет. Это высокоорганизованные виды, отличающиеся увеличенным размером мозга, к ним также относится человек, способный жить в социуме и имеющий развитое мышление.
Классификация плацентарных животных:
- афротерии;
- неполнозубые;
- бореозутерии;
- плацентарные грызуны.
К афротериям относится немногочисленная группа млекопитающих, обитающих в Африке и на Аравийском полуострове. Представителями этого обширного семейства являются даманы, трубкозубы, хоботовые млекопитающие и сирены. Неполнозубые включают 2 отряда и 29 видов, к ним относятся животные, обитающие в Южной, Северной и Центральной Америке.
Бореозутерии — инфракласс млекопитающих, проживающих в тропиках. К ним относятся таксоны и другие небольшие виды. Эта группа была выделена в результате проведённых молекулярных исследований животных, что и позволило определить их уникальность. Также выделяют разнообразных плацентарных грызунов, к которым относятся зайцеобразные, шерстокрылы и ряд других родов.
Функции плаценты
Отличительной особенностью таких животных является наличие у них временного органа — плаценты, которая существует лишь в период беременности. Она образуется из специальных клеток детского и материнского организма, являясь переходным участком и мостиком, по которому выполняется внутриутробное питание плода. Само происхождение слова плацента — греческое, что переводится как «лепёшка», объясняя необычный внешний вид этого органа.
Основные функции плаценты:
- транспортировка питательных веществ от матери к зародышу;
- обеспечение правильного газообмена кровяных систем матери и ребенка;
- выработка специальных гормонов, которые регулируют рост плода.
Сразу после родов плацента вместе с детенышем выходит во внешнюю среду, после чего перегрызается животными или самопроизвольно рвется. Кстати, интересен факт, что многие самки млекопитающих сразу после родов быстро съедают плаценту, так как в ней содержатся разнообразные полезные вещества и микроэлементы, необходимые для быстрого восстановления организма после тяжёлого периода беременности.
Последние исследования позволили установить, что сумчатые животные также имеют зачаточную плаценту, однако она растворяется в первые недели или месяцы беременности в зависимости от конкретного рода. Именно поэтому детёныши у них рождаются недоразвитыми, что существенно усложняет воспроизводство этих видов.
У многих плацентарных животных детеныши могут появляться на свет с различной степенью развитости. Например, зайцы и кролики относятся к одному отряду и рождают как зрячих детёнышей, так и голых и слепых.
Водные виды
К плацентарным животным относятся не только наземные млекопитающие, но и китообразные с ластоногими. Последние включают более 30 видов моржей, котиков и тюленей, которые большую часть своей жизни проводят в воде, выбираясь на сушу и лёд лишь во время линьки и размножения. Ластоногие являются объектами промысла, они дают пушнину, мясо, кожу и жир.
Также к отряду плацентарных относятся китообразные, которые включают более 80 видов. Это крупноразмерные животные, имеющие характерную рыбообразную форму тела. Передние конечности у них в процессе эволюции превратились в ласты, такие животные не имеют ушных раковин и шерстного покрова, но при этом слой подкожного жира может достигать у них 30 сантиметров и более. К этому отряду относятся не только разнообразные киты, но и кашалоты, дельфины и касатки.