Этап занятия
Длительность, мин.
Деятельность преподавателя
Деятельность студентов
Форма организации учебной
деятельности
Организационный момент / Мотивация
4
Описание темы сегодняшней лекции,
заполнение журнала присутствующих,
Во время описания темы студенты
слушают. Во время переклички встают
с места
фронтальная
Входной контроль
4
Задать три входных вопроса
аудитории, прослушать, при необходимости
поправить студентов или ответить
самому
Студенты слушают вопрос и размышляют
над ответом
фронтальная
Этап актуализации / Актуализация
знаний
5
Формулирует основные учебные
задачи, которые предстоит решить на
уроке
Внимательно слушают
фронтальная
Этап проблематизации
| Постановка проблемы
5
Формулировка проблемы решения с
комплексными и гармоническими числами
Внимательно слушают
фронтальная
Этап целеполагания и планирования
4
Формулировка целей данной темы,
для чего она нужна в будущей работе
Внимательно слушают
фронтальная
Изучение нового материала
21
Читает лекцию с презентации
Записывают в тетрадь слайды
презентации
фронтальная
Самостоятельная работа
3
Попросить студентов у себя в
тетрадях привести гармоническую
величину к комплексной форме
Решают пример в тетради
индивидуальная
Изучение нового материала
16
Читает лекцию с презентации
Записывают в тетрадь слайды
презентации
фронтальная
Закрепление / Повторение
/Систематизация знаний
12
Попросить студентов у себя в
тетрадях привести какую-либо
гармоническую величину к комплексной
форме и задать вопрос для дискуссии
Решают пример в тетради, после
размышляют над поставленным вопросом
индивидуальная
Самостоятельная работа
6
Предоставить студентам тест и
схему электрической цепи с исходными
данными и предложить им решить
Решают задачу в тетради
индивидуальная
Подведение итога
3
Краткий обзор всей презентации
Внимательно слушают
фронтальная
Этап рефлексии
3
Повторить студентам для чего им
необходимо уметь решать данные задачи
Внимательно слушают
фронтальная
Организация опережающей
самостоятельной работы. Задание на
дом
4
Дать студентам домашнее задание:
1)выполнить
расчет параметров электрической цепи
2) решить несколько
примеров с комплексными числами
Рисуют схему, переписывают примеры
в тетрадь
индивидуальная
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5
Сценарий учебного занятия по теме «Алюминий и его соединения»
Скачать:
Предварительный просмотр:
ИТОГОВАЯ РАБОТА СЛУШАТЕЛЯ КУРСОВ ПОВЫШЕНИЯ КВАЛИФИКАЦИИ
СЦЕНАРИЙ УЧЕБНОГО ЗАНЯТИЯ ПО ПРЕДМЕТУ
|
Сведения об авторе |
|
|
Фамилия, имя, отчество (полностью) |
Тюкалкина Ирина Игоревна |
|
Район |
Кстовский |
|
Место работы |
МАОУ Афонинская СШ |
|
Должность |
Учитель химии и биологии |
|
Общая информация |
|
|
Образовательная область, учебный предмет |
Химия |
|
Класс |
9 |
|
Авторская программа к учебникам (линии учебников или УМК) (если есть) |
Н Н Гара «Химия. Рабочие программы»Предметная линия учебников Г.Е.Рудзитиса Ф. Г,Фельдмана 8-9 классы учебное пособие для общеобразовательных организаций/ Н.Н.Гара – 3-е изд., перераб,- М Просвещение ,2019.-48 с |
|
Тема учебного занятия |
Алюминий и его соединения |
|
Тема урока или другой формы организации УВП: экскурсия, консультация, проект, лабораторное занятие, практикум, игра и т.п. |
|
|
Место урока или другой формы организации учебной деятельности в структуре учебного занятия |
Раздел «Металлы» |
|
Учебная задача
|
Задачи урока: Общеобразовательные: а) применение обобщенных знаний, умений и навыков в новых условиях – создание проблемной ситуации; б) контроль и самоконтроль знаний, умений и навыков с помощью домашней работы; в) уметь устанавливать существенные признаки, являющиеся основой различных классификаций; г) уметь устанавливать причинно-следственные связи между «составом», «химическими свойствами», «получением металла». Развивающие: а) развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли; б) развитие логического мышления, внимания и умения работать в проблемной ситуации. Воспитательные: а) формирование у учащихся познавательного интереса к химии; б) воспитание таких качеств характера, как настойчивость в достижении цели; в) воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения. Обще учебные: а) учебно — организационные: составлять таблицы. б) учебно – интеллектуальные: умения сравнивать, анализировать. в) учебно – информационные: пользоваться компьютером. |
|
Обобщенные цели учебного занятия — планируемые результаты |
|||
|
Цель Уровень |
Базовый («обучающийся научится») |
Повышенный («обучающийся получит возможность научиться») |
|
|
Цель – предмет (предметный результат) |
Обучающиеся научатся проверять свои знания, выявлять глубину понимания и прочность запоминания изученного на предыдущих занятиях. |
Обучающиеся получат возможность развивать мышление, самостоятельность, способность к рефлексии. |
|
|
Цель – способ (метапредметный результат) |
Обучающиеся откроют необходимые способы деятельности для последующей работы по осмыслению вновь изучаемого материала на текущем уроке. |
Обучающиеся получат возможность искать нестандартные решения. |
|
|
Цель – ценность (личностный результат) |
Обучающиеся убедятся в том, что понимают единство естественнонаучной картины мира и значимость естественнонаучных и математических знаний для решения практических задач в повседневной жизни. |
Обучающиеся получат возможность для формирования (позиции, понимания, убеждения, установки, оценки и т.п.) |
|
|
Исходное состояние обучающихся: — имеют опыт…….; — знают (факты, процессы, явления, понятия, теории и т.д.) — могут определять…….; — могут сравнивать, доказывать, аргументировать, сопоставлять; — могут планировать, проектировать, моделировать; — могут контролировать, оценивать и т.д. |
|||
|
Формы оценки планируемых результатов |
Предметный результат |
Метапредметный результат |
Личностный результат |
|
Составлять характеристику алюминия по его положению в Периодической системе химических элементов Д. И. Менделеева. Характеризовать строение, физические и химические свойства алюминия. Характеризовать физические и химические свойства оксида и гидроксида алюминия. Объяснять зависимость свойств (или предсказывать свойства) алюминия от положения в Периодической системе химических элементов Д. И. Менделеева. Составлять уравнения реакций, характеризующих химические свойства алюминия и его соединений: электронные уравнения процессов окисления-восстановления; уравнения электролитической диссоциации; молекулярные, полные и сокращенные ионные уравнения реакций с участием электролитов. Устанавливать причинно-следственные связи между строением атома, химической связью, типом кристаллической решетки алюминия и его соединений, его химическими свойствами. Наблюдать и описывать химический эксперимент. Вычислять по химическим формулам и уравнениям реакций, протекающим с участием алюминия и его соединений |
Познавательные: использовать знаковое моделирование; осуществлять сравнение, создавать обобщения, устанавливать аналогии, делать выводы; получать информацию из различных источников, структурировать и преобразовывать информацию из одной формы в другую (аспект смыслового чтения)), проводить наблюдение. Регулятивные: формулировать цель урока и ставить задачи, необходимые для ее достижения; планировать свою деятельность и прогнозировать ее результаты; работать в соответствии с изученными алгоритмами действий, сверять свои действия с целью и, при необходимости, корректировать ошибки самостоятельно. Коммуникативные: строить речевые высказывания в устной и письменной форме; выражать и аргументировать личную точку зрения |
Понимание значимости естественнонаучных знаний для решения практических задач. Формирование умения грамотного обращения с веществами в химической лаборатории и в быту |
|
|
Комментарии учителя к учебному занятию или уроку |
|
Учебно – информационное и техническое обеспечение учебного занятия |
||||
|
Учебно – информационное обеспечение |
Основная литература |
Дополнительная литература |
Интернет — ресурсы |
ЭОРы |
|
Г.Е.Рудзитис Ф.Г.Фельдман Учебник химии 9 класс-М Просвещение , 2018-207 с |
alm20.ru/index1283.php?Sposoby_polucheniya_alyuminiya |
http://www.ict.edu.ru/ http://www.ecolife.ru/index.shtml Программное обеспечение по химии http://chemicsoft.chat.ru/ Практическая и теоретическая химия http://chemfiles.narod.ru/ Популярная библиотека химических элементов http://n-t.ru/ri/ps/ |
||
|
Техническое обеспечение |
Оборудование: 1. Для лабораторных опытов: штативы для пробирок, пробирки, растворы: хлорид алюминия, гидроксида калия, соляной кислоты. 2. Для демонстраций: коллекция «Алюминий» и его сплавы, изделия из алюминия (кастрюля, столовые приборы, модель самолёта, бенгальские огни, алюминиевая проволока, фольга пищевая, серебрянка, новогодний «дождик», Альмагель);
|
|
Дидактическая структура учебного занятия (урока) и его психолого – педагогическое обоснование |
|||
|
Этап урока |
Подэтап урока |
Организация педагогически целесообразного взаимодействия (описываются конкретные методы и приемы, которые использует учитель на каждом подэтапе урока) |
Психолого – педагогическое обоснование (представляется смысловая характеристика организуемого образовательного процесса с точки зрения его соответствия требованиям развития обучающихся на конкретной ступени общего образования и педагогической концепции, на которой основывается деятельность учителя) |
|
1. Мотивационно ориентировочный |
1.1. Вхождение в контакт |
|
Создание комфортной психологической атмосферы урока |
|
1.2. Актуализация субъектного опыта обучающихся |
|
Переживание успешности практического действия, подтверждение значимости позиции ученика. |
|
|
1.3. Создание проблемной ситуации (конструктивного конфликта «знания – не знания», «умения – неумения», «понимания – не понимания» |
|
Создание проблемной ситуации – это новый поворот в уже знакомом материале, озадачивание. Разрыв непрерывности предметного действия, переживание невозможности дальнейшего движения требует обсуждения сложившейся ситуации. Выход из нее – определение задачи: «мы не знаем решения, но восстанавливаем путь, знаем, куда идти». Здесь возникает учебно-познавательный мотив, направляющий мыслительную деятельность обучающихся |
|
|
2. Операционно – исполнительский |
2.1. Целеполагание и планирование |
• Формулирование цели урока как прогностической модели ожидаемого результата • Построение ориентировочной основы учебной деятельности (план урока) |
Непосредственная постановка ученика в позицию субъекта целеполагания и планирования путем конструирования цели и плана с помощью заданных алгоритмов, представляющих цель в виде гипотезы, предположения, контура, который будет уже в процессе деятельности обрастать “плотью” |
|
2.2. Поиск способа решения проблемной ситуации |
|
Осуществление данного этапа учебной деятельности связано с содержательным анализом предметного материала, который направлен на поиск и выделение в целостном предмете основного и генетически исходного отношения |
|
|
2.3. Выбор верного варианта решения, фиксация найденного способа |
|
Действие моделирования направлено на отделение содержания от формы с помощью знаково-символических средств, представления этого содержания, что выступает существенным показателем понимания учащимися учебной задачи. В действии преобразования модели осуществляется переход от чувственного конкретного представления об исследуемом объекте к получению собственного знания о нем |
|
|
2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий |
|
В психологическом плане на этом этапе происходит интериоризация способа деятельности, а также очерчиваются границы его применимости |
|
|
3. Рефлексивно – оценочный |
3.1. Ситуация контроля за выполнением учебных действий |
|
Установление адекватности выбранной системы действий условиям учебной задачи — учащиеся анализируют правильность и полноту реализуемых действий в ходе решения учебной задачи |
|
3.2. Ситуация оценки образовательных результатов |
|
Осмысление процесса решения учебной задачи, ее предметных оснований, а также своих способностей к осуществлению данного рода учебных действий, усвоения их принципов построения |
|
Сценарий проведения учебного занятия |
|||
|
Этап урока или другой формы УВП |
Подэтап урока или другой формы УВП |
Действия учителя (педагога) |
Действия обучающихся (примерные версии ответов) |
|
1. Мотивационно ориентировочный |
1.1. Вхождение в контакт 1.2. Актуализация субъектного опыта обучающихся 1.3. Создание проблемной ситуации |
Фаза 1 «Начало образовательного мероприятия» 7 мин. Этап 1. Инициация Приветствие АМО «Я тебя знаю» (Шкатулка) (АДАПТИРОВАННЫЙ) Создание благоприятной позитивной обстановки, настрой на работу, на успех. 4 мин. Цель этапа: «Знакомство» друг с другом и повторение изученного на прошлых уроках. Создание доброжелательной обстановки на уроке. Технология проведения: Класс делится на 3группы, по числу рядов в классе. Каждый ряд – это форма существования элемента. Перед дверью поставить стул, на него шкатулку в которой листочки с заданием свернуты в трубочку: а) алюминий, как свободный атом: — порядковый номер AI=?; «адрес» алюминия в ПСХЭ Д. И. Менделеева; заряд ядра атома алюминия равен ?; число протонов в ядре атома AL =?; число нейтронов в ядре атома AL =?; число электронов в ядре атома AL =?; электронная схема AL =?; электронная формула AL =?; число валентных электронов в атоме AL =?; степень окисления атома AL =?. б) алюминий, как простое вещество: Ar (AI) =?; Mr (AI) =?; M (AI) =?; вид химической связи AI=?; тип кристаллической решетки AI=?; сколько алюминий отдает электронов?; сколько алюминий принимает электронов?; какие свойства проявляет алюминий?; алюминий металл или неметалл? в) алюминий, как сложное вещество – формула оксида алюминия, формула гидроксида алюминия; формула хлорида алюминия; формула сульфата алюминия; формула нитрата алюминия; дайте название веществу – AI2O3; дайте название веществу – AI(OH)3; дайте название веществу – AIPO4; дайте название веществу – AI2(CO3)3; дайте название веществу – AI2S3. |
Ученик берет листочек с заданием и садится на соответствующий ряд своему заданию, пишет ответ и вставляет в бейджик. Потом в импровизированной форме называют «свое имя» знакомятся с соседом по парте, при этом пожимая друг другу руку. |
|
2. Операционно – исполнительский |
2.1. Целеполагание и планирование 2.2. Поиск способа решения проблемной ситуации е |
Этап 2. Погружение в тему. Название метода: Дидактическая игра « Сходство и отличие». Совместное целеполагание. 3 мин. Учитель: — Мы продолжаем изучение большой и важной темы “Металлы”. Сегодня нам предстоит познакомиться с металлом хорошо знакомым вам с детства. Для этого посмотрите на доску и сделайте задание. Цель этапа: Обеспечение мотивации обучения и осмысленности процесса обучения. Совместное целеполагание. Технология проведения: Учитель записывает на доске разные формулы, в составе которых есть алюминий, и просит ребят найти между ними общее и чем они отличаются. Учитель: — Для подтверждения своих предположений послушайте одну красивую, но, вероятно, неправдоподобную легенду из «Historia naturalis». Однажды к римскому императору Тиберию пришел незнакомец. В дар императору он преподнес изготовленную им чашу из блестящего, как серебро, но чрезвычайно легкого металла. Мастер поведал, что этот ни кому неизвестный металл он сумел получить из глинистой земли. Должно быть, чувство благодарности редко обременяло Тиберия, да и правителем он был недальновидным. Боясь, что новый металл с его прекрасными свойствами обесценит хранившееся в казне золото и серебро, он отрубил изобретателю голову, а его мастерскую разрушил, чтобы никому неповадно было заниматься производством «опасного» металла. О каком металле идёт речь? Формулировка темы урока, его цели и задач осуществляется с помощью выполнения этого задания с опорой на ранее приобретённые знания и собственные наблюдения. Учитель: — Таким образом, тема нашего урока: «Алюминий и его соединения». Цель: изучать самый распространенный металл на Земле и его соединения. Задачи:
Ребята, на ваших столах находятся кластеры. Эти кластеры будут нашими маршрутами при изучении темы. Именно по ним мы будем поэтапно изучать самый распространенный металл на земле. Учитель: Алюминий относится к р-элементам, переходной элемент, соединения которого обладают амфотерными свойствами. Металл. Алюминий занимает промежуточное положение между металлами и неметаллами. Металлические свойства у него должны быть выражены слабее, чем у натрия и магния. Наличие у него 3 электронов на внешнем уровне и несколько меньший радиус атома обуславливает уменьшение химической активности алюминия по сравнению с соответствующими элементами I и II групп) Учитель: — Для решения вопроса об активности алюминия, что мы должны рассмотреть? Учитель: Почему алюминия нет в свободном виде в природе? Обратите внимание на положение алюминия в электрохимическом ряду напряжения металлов. |
(Ответ: об алюминии) После выполнения предыдущих заданий в классе разворачивается коллективное обсуждение по следующим вопросам: 1.Сколько электронов находится на внешнем уровне атома алюминия? Ответ: три электрона.2.Какую степень окисления проявляет алюминий? Ответ: +3.Алюминий будет отдавать или принимать электроны? Ответ: отдавать. Значит алюминий это…Ответ: металл. 4. Какой же это металл: активный или неактивный? Ответы могут быть разные: из своего жизненного опыта ребята отвечают, что это неактивный металл (алюминиевые провода не реагируют с водой), другие делают предположение об активности алюминия, так как он находится в электрохимическом ряду напряжения металлов сразу после активных металлов. |
|
2.3. Выбор верного варианта решения, фиксация найденного способа |
Фаза 2 «Работа над темой» Этап 3. Инпут Интерактивная лекция – презентация: «Алюминий и его соединения» 22 мин. Цель: Сообщение нового материала.
Учитель: Изучив физические свойства алюминия, можно ли предсказать активный или пассивный этот металл? Ответ – нет.
Взаимодействие с простыми веществами: с йодом, бромом – (демонстрация видео); с О2 (Демонстрация – горение «бенгальских» огней); Взаимодействие со сложными веществами: с разбавленными кислотами — HCI и Н2SO4 Записать соответствующие уравнения реакции. Учитель: Какой же это металл: активный или пассивный? Ответ: активный. А теперь рассмотрим взаимодействие алюминия с водой и Н2SO4(конц), HNO3(конц). Учитель: Алюминий, стоящий в начале ряда напряжений металлов, проявляет химическую пассивность. Почему? Причину пассивности выясним, посмотрев опыт «плавление алюминия» Внимание на экран (видео). Учитель: Концентрированные серная и азотная кислоты пассивируют алюминий образуя на поверхности металла плотную, прочную оксидную пленку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах. Если удалить пленку, то алюминий должен проявлять активность, близкую к щелочноземельным металлам. Без оксидной пленки он способен реагировать с водой при обычных условиях. С водой (при удалении оксидной пленки) 2АI+6H2O=2AI(OH)3 + 3H2↑
Учитель: Почему алюминия нет в свободном виде в природе? Ответ: Исходя из положения алюминия в электрохимическом ряду напряжений металлов, можно заключить, что он обладает высокой химической активностью и поэтому не встречается в природе в свободном состоянии.
Учитель: Алюминий получают электролизом оксида алюминия Al2O3 в расплаве криолита. Процесс электролиза, в конечном итоге, сводится к разложению Al2O3 электрическим током: 2 Al2O3 —> 4Al + 3O2
Оксид алюминия Аl2O3 — белое вещество с очень высокой температурой плавления, термически стойкий, гигроскопичный. По химическим свойствам это амфотерный оксид. Как основный он реагирует с кислотами: Al2O3 + 6HCl = 2AlCl3 + 3H2O Как кислотный – со щелочами: Al2O3 +NaOH =2NaAlO2 + H2O Может быть получен разложением при нагревании соответствующего ему гидроксида алюминия: 2AI(OH)3 = Аl2O3+ 3H2O Применение: Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал. Гидроксид алюминия Аl(ОН)3 — белый, аморфный или кристаллический порошок. Практически не растворяется в воде. Его получают при взаимодействии раствора щелочи с раствором соли алюминия. Al2(SO4)3 + 6NaOH = 2Al(OH)3↓ + 3Na2SO4 Эта реакция является качественной на ионы Al3+. При действии раствора щелочи на соль алюминия образуется белый осадок Al(OH)3, который растворяется в избытке щелочи. Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + NaOH = NaAlO2 + 2H2O Применение: Используется при очистке воды, так как обладает способностью поглощать (адсорбировать) различные вещества. В медицине, в качестве антацидного средства (для лечения кислотозависимых заболеваний желудочно-кишечного тракта посредством нейтрализации соляной кислоты, входящей в состав желудочного сока – «Альмагель»). Применяется в качестве антипирена (подавителя горения) в пластиках, полимерных, лакокрасочных материалах. Разлагается при нагревании.
Алюминий широко используют в металлургии для получения металлов — хрома, марганца, ванадия, титана, циркония из их оксидов. Как вы помните, этот способ носит название алюминотермии. На практике часто применяют термит — смесь Fe3O4 с порошком алюминия. Если эту смесь поджечь, например, с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты: 8 AI + 3 Fe3O4 = 4 Al2O3 + 9 Fe Выделяющейся теплоты вполне достаточно для полного расплавления образующегося железа, поэтому этот процесс используют для сварки стальных изделий. Задание: зная физические и химические свойства алюминия, предположите области его применения. Учитель: Оказывает ли алюминий влияние на здоровье человека? 7. Биологическая и экологическая роль алюминия и его соединений. 2 мин. (Слайд №…) |
Ответ: Физические и химические свойства алюминия. Ответ: Исходя из положения алюминия в электрохимическом ряду напряжений металлов, можно заключить, что он обладает высокой химической активностью и поэтому не встречается в природе в свободном состоянии. Примерные ответы. Физические свойства алюминия: серебристо- белого цвета; твердость. Аl – 2,9; плотность. Аl – 2,7 , лёгкий; температура плавления Al – 660 (вольфрам – 3370 , натрий – 98); большая электро- и теплопроводность; очень пластичен. Взаимодействие со сложными веществами: с разбавленными кислотами — HCI и Н2SO4 Записать соответствующие уравнения реакции.
Ответы: основные области применения алюминия связаны с легкостью, прочностью и устойчивостью. В таком сочетании полезных свойств нуждается в первую очередь транспорт. Главные потребители алюминиевых сплавов – самолетостроение и автомобилестроение. Учащиеся смотрят учебник, и продолжают отвечать с добавлением учителя: указанные свойства алюминиевых сплавов, а также их красивый внешний вид обусловили широкое применение их в строительстве. Алюминий и его сплавы используют при отделке станций метрополитена, фасадов зданий. Гофрированными листами сплавов покрывают крыши. Высокая электрическая проводимость чистого алюминия используется в электротехнике. Из алюминия изготавливают электропровода. При одинаковом электрическом сопротивлении масса алюминиевого провода значительно меньше массы медного. Это облегчает сооружение опорных мачт, на которые подвешиваются провода. Широко применяется “серебряная краска” на основе алюминиевого порошка. Она не только придает красивый внешний вид изделиям, но и защищает их от химического разрушения. Для защиты от солнечных лучей покрывают цистерны, предназначенные для перевозки нефтепродуктов. В быту алюминий используют в виде кухонной посуды. Здесь используются такие свойства как высокая теплопроводность, способность противостоять действию не только холодной, но и кипящей воды и не ядовитость его соединений, которые в небольшом количестве могут образоваться при действии на алюминий слабых органических кислот, содержащихся в пище. |
|
|
2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий |
Этап 4. Проработка содержания темы. 10 мин. «Проблема – решение – ответ» (лабораторная работа). Цель: Доказательство амфотерности алюминия. (Проблемный вопрос к лабораторному опыту): математики утверждают, что от перестановки мест слагаемых сумма не меняется. А вот химики считают, что это не всегда справедливо. Убедитесь в этом, меняя порядок приливания растворов: хлорида алюминия и гидроксида калия. Работаем по инструкции. Вспомним о ТБ. (Если пролита кислота – проточная вода, р-р питьевой соды; если щелочь – вода, 2% р-р уксусной кислоты). Работаем в парах. Делаем поэтапно. Наблюдаем, записываем уравнения в ионном виде. За каждое уравнение по 1 баллу.
|
При взаимодействии с кислотами гидроксид алюминия проявляет …….свойства, а при взаимодействии со щелочами гидроксид алюминия проявляет …….свойства. Следовательно, гидроксид алюминия — …………соединение. Вывод: гидроксид алюминия – амфотерное соединение. Амфос в переводе с греческого означает реагирует с тем и с другим. А как распознать ионы алюминия? (Добавить к соли р-р щелочи, выпадает белый осадок, растворимый в избытке щелочи). |
|
|
3. Рефлексивно – оценочный |
3.1. Ситуация контроля за выполнением учебных действий |
Этап 5. Эмоциональная разрядка (разминка). 2 мин. Название метода – Эссе. Цель: Снятие напряжения и усталости и расслабление. Завершение образовательного процесса. Д/З – мини сочинение 3-5 предложений от имени алюминия «Я самый, самый…» Фаза 3. «Завершение образовательного мероприятия». |
|
|
3.2. Ситуация оценки образовательных результатов |
Этап 6. Рефлексия. 4 мин. Название метода: «Смайлики», «Волшебный микрофон» Цели задачи использования метода: Получение эмоциональной и содержательной оценки процесса и результатов обучения Подробная технология проведения: В тетради, в конце темы нарисовать смайлик соответствующий уроку. Подведение итогов — « волшебный микрофон» Продолжите предложения: 1. Сегодня я понял… 2. Теперь я могу… 3. Меня удивило… и т.д. |
ГБОУ ДПО «НИЖЕГОРОДСКИЙ ИНСТИТУТ РАЗВИТИЯ ОБРАЗОВАНИЯ»
Сценарий учебного занятия по предмету «химия» с использованием элементов профориентационной работы

| Сведения об авторе | |
|
Фамилия, имя, отчество (полностью) |
Малий Ирина Викторовна |
|
Район |
Сормовский |
|
Место работы |
МАОУ «Школа № 78» |
|
Должность |
учитель |
| Общая информация | |
|
Образовательная область, учебный предмет |
химия |
|
Класс |
9 |
|
Авторская программа к учебникам (линии учебников или УМК) (если есть) |
|
|
Тема учебного занятия |
|
|
Тема урока или другой формы организации УВП: экскурсия, консультация, проект, лабораторное занятие, практикум, игра и т.п. |
Металлы в природе, общие способы их получения Тип урока: урок изучения и первичного закрепления знаний (изучение и первичное осознание нового учебного материала, осмысление связей и отношений в объектах изучения) |
|
Место урока или другой формы организации учебной деятельности в структуре учебного занятия |
ТЕМА 1 Металлы.(18 часов) 1. Положение металлов в периодической системе. Строение их атомов, кристаллических решеток. Физические свойства. 2.Общие химические свойства металлов. 3. Коррозия металлов. Сплавы 4. Металлы в природе, общие способы их получения 5. Общая характеристика элементов главной подгруппы I группы(щелочные металлы) 6. ………… |
|
Учебная задача |
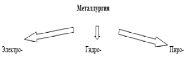
Создать условия для усвоения обучающимися комплекса теоретических знаний о природных соединениях металлов и самородных металлах, способах их прикладного использования. Дать понятие о рудах и металлургии, рассмотреть такие ее разновидности, как пиро-, гидро- и электрометаллургия; вовлечь учащихся в исследовательскую деятельность. |
| Обобщенные цели учебного занятия — планируемые результаты | |||
|
Уровень |
Базовый («обучающийся научится») |
Повышенный («обучающийся получит возможность научиться») |
|
|
Цель – предмет (предметный результат) |
создать условия для ознакомления учащихся с природными соединениями металлов, формирования понятий о самородных металлах, минералах и рудах; ознакомления с металлургией и её видами: пиро-, гидро-, электрометаллургией. Дать понятие «металлотермия». Создать условия для ознакомления с микробиологическими способами получения металлов.… |
Обучающиеся получат возможность научиться получать некоторые металлы в лаборатории. |
|
|
Цель – способ (метапредметный результат) |
Обучающиеся овладеют навыками работы с текстовой информацией при обращении к учебному пособию; осуществлять логические операции при разрешении проблемной ситуации; организовывать собственную познавательную деятельность при выполнении опытов; концентрировать внимание; свободно и правильно излагать свои мысли исходя из сделанных выводов; осуществлять самоконтроль и оценку своей деятельности; предвидеть возможные результаты своих действий. |
Обучающиеся получат возможность оценить усвоенное содержание исходя из социальных и личностных ценностей; оптимальность лабораторных и промышленных способов получения некоторых металлов. |
|
|
Цель – ценность (личностный результат) |
Обучающиеся, сформируют представление о значимости школьных знаний в области химии в приобретении профессии технической направленности. |
Обучающиеся получат возможность развития интеллекта, мышления, саморазвития и самосовершенствования своей личности. Обучающиеся получат возможность для формирования убеждения в том, что в нашем современном мире — в мире технологий самыми востребованными являются специальности технической направленности. А чтобы стать высококлассным специалистом, необходимо еще в школьные годы приложить свои усилия в изучении таких предметов, как физика, математика и химия. |
|
|
Исходное состояние обучающихся: |
— имеют опыт работы с различными источниками информации; — знают понятия: металлы, физические и химические свойства металлов, амфотерные элементы, степень окисления; — могут самостоятельно определять тему урока, формулировать цели и задачи урока, а также цели и задачи эксперимента; — могут осуществлять интеграцию химических, биологических и экологических знаний, выявлять экологические проблемы металлургии и их последствия, возникающие при взаимодействии человека и природы. — обладают теоретическим, наглядно-образным, формальным и рефлексивным мышлением — большинство владеют основными видами логических операций (анализ, синтез, обобщение, классификация, аналогия, сопоставление); — часть ребят могут осуществлять прогностическую деятельность, выдвигать гипотезы, доказывать или опровергать их; |
||
|
Формы оценки планируемых результатов |
Предметный результат |
Метапредметный результат |
Личностный результат |
|
|
|
|
|
Комментарии учителя к учебному занятию или уроку |
Данная тема изучается в теме «Металлы» на уроках химии в 9 классе и занимает одно из главных мест, т.к. здесь идёт знакомство с важнейшими простыми веществами — металлами и соединениями металлов, которые нас окружают. Знания, полученные на данном уроке, будут востребованы при изучении химических свойств разделе «Свойства растворов электролитов» и при изучении курса химии в 11 классах, при подготовке к ОГЭ и ЕГЭ. Тема может быть использована при проведении профориентационной работы так как практически все технические профессии связаны с изучением металлов, их свойств, с изучением их возможностей, а значит со знанием таблицы Менделеева, с которой мы знакомимся еще в школьные годы на уроках химии. |
| Учебно – информационное и техническое обеспечение учебного занятия | ||||
|
Учебно – информационное обеспечение |
Основная литература |
Дополнительная литература |
Интернет — ресурсы |
ЭОРы |
|
УМК: — Габриелян О. С., Химия 9 класс, Учебник для общеобразовательных учреждений, М. Дрофа, 2009. — Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа, 2005. — Контрольные и проверочные работы. Химия 9 класс к учебнику О.С.Габриеляна. М. Дрофа, 2008. |
— Габриелян О.С., Лысова Г.Г., Введенская А.Г. Химия 9 класс. Настольная книга учителя. М. Дрофа, 2003. — Габриелян О.С., Рунов Н.Н. Химический эксперимент в школе 8-11 класс. М. Дрофа, 2005. — Габриелян О.С., Остроумов И.Г. Общая химия в тестах, задачах, упражнениях. 9 класс. Учебное пособие для общеобразовательных учреждений. М. Дрофа, 2003. |
https://ru.wikipedia.org Википедия fcior.edu.ru/ Федеральный центр информационно-образовательных ресурсов school-collection.edu.ru/ Единая коллекция цифровых образовательных ресурсов www.oblasti-ekologii.ru Экология природных ресурсов |
http://edufuture.biz/index.php?title Onov43.jpg Onov39.jpg |
|
|
Техническое обеспечение |
Раздаточный материал к уроку: — теоретическая часть: папки дидактических материалов «Твой помощник по химии» (тема «Общие способы получения металлов»); — практическая часть: коллекции минералов и руд; индивидуальные карточки для выполнения домашней самостоятельной работы (с инструктированием по дифференцированному выполнению заданий). ИКТ-средства обучения: мультимедийное сопровождение урока. Авторская учебная презентация «Общие способы получения металлов» |
| Дидактическая структура учебного занятия (урока) и его психолого – педагогическое обоснование | |||
| Этап урока | Подэтап урока | Организация педагогически целесообразного взаимодействия (описываются конкретные методы и приемы, которые использует учитель на каждом подэтапе урока) | Психолого – педагогическое обоснование (представляется смысловая характеристика организуемого образовательного процесса с точки зрения его соответствия требованиям развития обучающихся на конкретной ступени общего образования и педагогической концепции, на которой основывается деятельность учителя) |
|
1. Мотивационно ориентировочный |
1.1. Вхождение в контакт |
Подготовка учащихся к учебной деятельности По источнику передачи и восприятию учебной информации: словесные (беседа) Методы стимулирования интереса к учению: предъявление требований учителем |
Создание комфортной психологической атмосферы урока |
|
1.2. Актуализация субъектного опыта обучающихся |
По источнику передачи и восприятию учебной информации: словесные (беседа) По степени самостоятельности и активности мышления учащихся: репродуктивный (ответы на вопросы, работа по карточкам); По характеру управления учебной работой: самостоятельная работа (выполнение письменных заданий). Включение каждого в конкретную деятельность на уже освоенном материале. |
Переживание успешности практического действия, подтверждение значимости позиции ученика. |
|
|
1.3. Создание проблемной ситуации (конструктивного конфликта «знания – не знания», «умения – неумения», «понимания – не понимания» |
По источнику передачи и восприятию учебной информации: словесные (эвристическая беседа) По степени самостоятельности и активности мышления учащихся: продуктивный – проблемное изложение (проблемная ситуация) По характеру управления учебной работой: под руководством учителя. Методы стимулирования интереса к учению: создание ситуации занимательности. |
Создание проблемной ситуации – это новый поворот в уже знакомом материале, озадачивание. Разрыв непрерывности предметного действия, переживание невозможности дальнейшего движения требует обсуждения сложившейся ситуации. Выход из нее – определение задачи: «мы не знаем решения, но восстанавливаем путь, знаем, куда идти». Здесь возникает учебно-познавательный мотив, направляющий мыслительную деятельность обучающихся |
|
|
2. Операционно – исполнительский |
2.1. Целеполагание и планирование |
• Формулирование цели урока как прогностической модели ожидаемого результата • Построение ориентировочной основы учебной деятельности (план урока)
Определение домашнего задания и инструктаж по его выполнению. |
Непосредственная постановка ученика в позицию субъекта целеполагания и планирования путем конструирования цели и плана с помощью заданных алгоритмов, представляющих цель в виде гипотезы, предположения, контура, который будет уже в процессе деятельности обрастать “плотью” |
|
2.2. Поиск способа решения проблемной ситуации |
По источнику передачи и восприятию учебной информации: наглядные (мультимедийная презентация, демонстрация ЭОР) По степени самостоятельности и активности мышления учащихся: репродуктивный (работа с книгой), продуктивный (проблемная ситуация, диалог). По характеру управления учебной работой: под руководством учителя. Методы стимулирования интереса к учению: создание ситуации занимательности, создание ситуации успеха, проведение лабораторного опыта, демонстраций. |
Для подростков все большее значение начинает приобретать теоретическое мышление, способность устанавливать максимальное количество смысловых связей в окружающем мире — в системе исторически обусловленной реальности человеческого существования. Он психологически погружен в реальности предметного мира, образно-знаковых систем, природы и социального пространства. Изучаемый в школе материал становится для подростка условием для построения и проверки своих гипотез. Конечно, такое погружение в реалии человеческого бытия происходит постепенно, наращиваясь к концу подросткового — началу юношеского возраста. Также продолжает развиваться наглядно-образное и словесно-логическое мышление, способность воплощать теоретические знания в практическую деятельность. |
|
|
2.3. Выбор верного варианта решения, фиксация найденного способа |
По источнику передачи и восприятию учебной информации: словесные (сообщения учащихся), наглядные (мультимедийная презентация, демонстрация ЭОР) По степени самостоятельности и активности мышления учащихся: репродуктивный (работа с книгой), продуктивный (выполнение опыта учащимися, проблемная ситуация, диалог). По характеру управления учебной работой: самостоятельно, под руководством учителя. Методы стимулирования интереса к учению: создание ситуации занимательности, создание ситуации успеха, проведение лабораторного опыта. |
Подростковый возраст (14 — 15 лет) характеризует ведущая деятельность — интимно-личностное общение со сверстниками, содержанием которого выступает установление близких отношений с партнером, познание партнера и самопознании, (целесообразно выполнение работ в парах, группах) а старший подростковый возраст (15 — 17 лет) — учебно-профессиональная, как овладение системой научных понятий в контексте предварительного профессионального самоопределения. К. Н. Поливанова называет ведущей «проектную деятельность», в которой реализуется «авторское действие» подростка (подготовка сообщений, презентаций). |
|
|
2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий |
По источнику передачи и восприятию учебной информации: практические (выполнение заданий). По степени самостоятельности и активности мышления учащихся: репродуктивный (письменные задания, ситуационная задача), продуктивный (проблемный и частично-поисковый – ситуационная задача). По характеру управления учебной работой: самостоятельная работа. Методы контроля и самоконтроля: письменный контроль и взаимоконтроль. Методы стимулирования интереса к учению: компетентностно-ориентированные задания, предъявление требований учителем к выполнению заданий. Контекстное обучение (использование ситуационных задач). |
Обучающиеся самостоятельно осуществляют выбор системы действий для решения ситуационной задачи, адекватной открытому способу. |
|
|
3. Рефлексивно – оценочный |
3.1. Ситуация контроля за выполнением учебных действий |
|
Установление адекватности выбранной системы действий условиям учебной задачи — учащиеся анализируют правильность и полноту реализуемых действий в ходе решения учебной задачи |
|
3.2. Ситуация оценки образовательных результатов |
По источнику передачи и восприятию учебной информации: словесные (беседа). По характеру управления учебной работой: формирование убеждения в социальной и личной значимости изученного материала. Методы стимулирования интереса к учению: комментирование учителем достижений и результатов обучающихся. |
Выявление уровня осознания каждым обучающимся степени освоенности содержания (знаю что?), владения действиями (знаю как?), понимания смысла изученного (знаю зачем?) и понимания степени своих личностных приращений (знаю, что во мне изменилось?) Восьмиклассники только учатся делать самоанализ собственной деятельности. |
| Сценарий проведения учебного занятия | |||
| Этап урока или другой формы УВП | Подэтап урока или другой формы УВП | Действия учителя (педагога) | Действия обучающихся
(примерные версии ответов) |
|
1. Мотивационно ориентировочный |
1.1. Вхождение в контакт |
Мотивация учащихся к учебной деятельности посредством спокойной, уверенной манеры поведения, приветливого и доброжелательного тона. Взаимные приветствия учителя и учащихся. Отметка в классном журнале отсутствующих. Проверка подготовленности к уроку (рабочее место, рабочая поза, внешний вид), организация внимания. |
Приготовление учащихся к работе на уроке. Концентрация внимания и мобилизация на предстоящую деятельность |
|
1.2. Актуализация субъектного опыта обучающихся |
Выясняет степень усвоения заданного на дом материала. 1. Предлагает ученикам обменяться в парах кроссвордами и осуществить взаимное оценивание. Кроссворд оценивается по заданному алгоритму. «5»-работа выполнена самостоятельно без ошибок «4»-правильно, но с помощью; «3»-работа выполнена с 4 ошибками. Оценки заносятся в рабочую карту 2. Работа с учебной презентацией: создание условий для самостоятельного оценивания письменного задания учащимися |
1.Учащиеся в парах оценивают кроссворды (самостоятельное оценивание или взаимное оценивание) по теме «Металлы». Сдают работы учителю в конце урока. 2.Самостоятельное оценивание письменной работы по образцу (по презентации). Сдают письменные работы по желанию. |
|
|
1.3. Создание проблемной ситуации |
Ставит перед учащимися учебную проблему: «Почему одни металлы могут встречаться в природе в самородном виде, а другие – только в составе соединений?» «Каким же образом извлечь металлы из их минералов и руд?» «А руды и минералы – это не одно и то же?» |
Анализируют информацию, отвечают на вопросы, работают в парах. |
|
|
2. Операционно – исполнительский |
2.1. Целеполагание и планирование |
Обеспечение мотивации и принятия цели учебно-познавательной деятельности. (Рассказ учителя) Практически все технические профессии: «Сварщик», «Автомеханик», «Электромонтер», «Слесарь по контрольно-измерительным приборам и автоматике», «Слесарь по ремонту и обслуживанию газового оборудования» связаны с изучением металлов, их свойств, с изучением их возможностей, а значит со знанием таблицы Менделеева, с которой мы знакомимся еще в школьные годы на уроках «Химии». Много веков металлы верно служат человеку, помогая ему покорять стихию, овладевать тайнами природы, создавать замечательные машины и механизмы. Богат и интересен мир металлов. Среди них есть старые друзья человека: медь, железо, золото, ртуть, серебро, олово. Эта дружба насчитывает уже тысячи лет. Но есть и такие металлы, знакомство с которыми состоялось лишь несколько десятилетий назад. Многое о металлах вы уже знаете. Посмотрите, на какие вопросы нам предстоит ответить именно сегодня.
|
Формулируют тему урока, цели, задачи, предлагают пути достижения поставленной цели урока, определяют ход деятельности на уроке. Готовятся к активной учебно-познавательной деятельности. |
|
2.2. Поиск способа решения проблемной ситуации |
Концентрирует внимание учащихся; сообщает новый материал, обеспечивая восприятие, осознание, систематизацию и обобщение этого материала с помощью наглядных средств информации – учебной презентации к уроку, коллекций минералов и руд, раздаточного дидактического материала «Твой помощник по химии» 1.Сегодня мы рассмотрим не только нахождение металлов в природе, но и, как связаны между собой химическая активность металлов и нахождение металлов в природе. Объяснение учителя, заполнение таблицы на доске, сопровождающееся объяснением учителя с опорой на знания учеников, и в тетрадях. Демонстрация слайдов №1, №3-10 (тема «Получение металлов») 2. Природные химические соединения металлов называют минералами. минералы, содержащие в количествах. пригодных для получения в промышленности, называют рудами. 3. Составим еще одну классификацию природных соединений металлов по признаку принадлежности минералов к одному из классов неорганических соединений |
Внимательно изучают новый материал с помощью предоставленных учителем средств, фиксируя основные моменты темы в тетради. Рассматривают коллекцию минералов и горных пород. Делают необходимые выводы. Место металла в 2-й, 3-й, или 4-й колонках определяется учениками, после рассмотрения образцов на слайдах коллекции. Коллективное устное обсуждение таблицы с классом Один ученик работает у доски с помощью учителя, класс записывает в тетради «Формы существования металлов в природе» Металл –– минерал –– руды соединение соединение содержащее металл, в коли чествах, при годных для его выплавки Минералы, руды Оксиды Соли Таблица заполняется учениками по учебнику [2], работа в парах. Затем проверяется – вызванный ученик зачитывает свой вариант, и учитель предлагает классу составить третью классификацию природных соединений металлов по кислотному остатку минералов, заполнить вторую колонку таблицы № 2, работа в парах. Затем учитель вызывает пару учеников, которые зачитывают свой вариант, и обсуждают его с классом. |
|
|
2.3. Выбор верного варианта решения, фиксация найденного способа |
Беседа учителя с учащимися 1. Назовите, в каком виде встречаются металлы в природе? 2. Как это связано с химической активностью металлов? 3. Какая таблица отражает эти закономерности нахождения металлов в природе? Металлургия – наука и отрасль промышленности, изучающая получение металлов из руд 1. Что такое руды? 2. Какие руды вам известны? 3.Ребята, как вы думаете, из каких руд легче всего получить металл в чистом виде и почему? Рассказ учителя Наиболее пригодны для получения металлов оксидные руды, затем сульфидные, следующие карбонатные руды и сульфаты. Например, железо получают именно из оксидных руд, поэтому такие руды имеют наибольшее значение. Следующими считаются сульфидные руды железа. Среди оксидных руд железа наиболее удобен для переработки магнитный железняк Fe3O4, так как там наибольший процент содержания железа по сравнению с другими образцами. А какие общие способы получения металлов, сопровождающие их химические процессы 1. Написать схему восстановления металлов из ионов. 2. Что такое чугун? 3. Что такое сталь? Объяснение учителя, демонстрация химических реакций, параллельно запись реакций в тетрадь, на доске учениками с помощью учителя. В зависимости от способа извлечения металла из руды выделяют следующие виды металлургических процессов 1. Электрометаллургия – выделение металлов из их солей и оксидов под действием электрического тока Демонстрация слайда №2 (тема «Получение металлов») 2. Гидрометаллургия – методы получения металлов, основанные на химических реакциях, протекающих в растворах Демонстрация опыта 3. Пирометаллургия – методы извлечения металлов из руд под действием высоких температур. Оксидные руды и оксиды восстанавливают углем, оксидом углерода (II), более активным металлами (алюминий, магний, натрий) Демонстрация видео слайда №11 (тема «Получение металлов») Сульфидные руды подвергаются обжигу: |
Ответы учащихся 1.Металлы встречаются в природе как в чистом виде так и виде соединений. 3.Электрохимический ряд напряжения металлов. 1.Руды – это минералы, содержащие металл в количествах, достаточных для получения его в промышленности. 2.Руды бывают оксидные, сульфидные, карбонаты, сульфаты, хлориды, нитраты. Предположения учащихся Учащиеся рассматривают коллекцию руд железа (работа в группах) Ученик у доски пишет схему (Me+n + ne –– Me0) Ответы на вопросы находят в учебнике 2.Чугун – сплав на основе железа, содержащий от 2 – 4,5 % углерода, а также марганец, кремний, фосфор и серу. 3. Сталь – сплав на основе железа, содержащий не менее 2% углерода. параллельно запись схем и реакций в тетрадь, на доске учениками с помощью учителя. NaCl — электролиз –– 2Na + Cl2 CuSO4 + Fe –– FeSO4 + Cu FeO + C –– Fe + CO Fe2O3 + 2Al –– 2Fe + Al2O3 2ZnS + 3O2 –– 2ZnO + 2SO2 Доклад «От руды к чугуну» (Приложение 3). Доклад «От чугуна к стали» (Приложение 3). Демонстрация слайдов № 3, 4, 5 (тема «Железо») Доклад или презентация заранее готовятся группой учеников, где распределены роли среди участников: руководитель, помощники, докладчик. В сданной учителю работе должны быть выставлены оценки самими исполнителями работы, а также она оценивается классом, если есть или высказываются замечания. Доклад обсуждается с классом. |
|
|
2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий |
Для закрепления полученных знаний, выполните лабораторную работу «Исследование физических свойств оксидных руд железа». |
Выполняют по инструкции (Приложение 4) исследование физических свойств руд железа, записывают результаты в лист наблюдений, предварительно обсудив в группе. Работа в группах, с распределением функций участников: руководитель, выполняющий эксперименты, ученик, который ведет протокол, то есть пишет уравнения реакций и наблюдения. В процессе выполнения работы в группе коллективно выставляют каждому оценку. Результаты обсуждаются в классе |
|
|
3. Рефлексивно – оценочный |
3.1. Ситуация контроля за выполнением учебных действий |
1.С какими видами металлургических процессов вы сегодня познакомились? 2. Какие этапы переработки железа вы знаете? 3. Как вы думаете от чего зависит, в какой форме будет находиться металл в природе? 4. От чего зависит способ переработки руды для получения металла? Таким образом, мы видим, что получение металлов зависит от химической активности металлов, то есть химических свойств, а также от количественного и качественного состава природных соединений металлов. 5.В каких отраслях деятельности человека используются знания о металлах? Какие профессии связаны с этими знаниями? |
На основе анализа и синтеза фактов делают самостоятельные выводы и обобщения, при этом не исключаются объяснения учителя и репродуктивная деятельность. Обсуждение выполнения задания. 1.В зависимости от способа получения металлов выделяют пиро-. гидро-, электрометаллургия. 2. От руды к чугуну, от чугуна к стали Затем с помощью учителя ученики делается вывод по уроку. Сегодня мы рассмотрели нахождение металлов в природе и получение металлов. 3.Форма нахождения металла в природе зависит от химической активности металла 4.Способ получения металла зависит от вида, в котором находится металл в природе, то есть от руды. 5.Практически все технические профессии: «Сварщик», «Автомеханик», «Электромонтер», «Слесарь по контрольно-измерительным приборам и автоматике», «Слесарь по ремонту и обслуживанию газового оборудования» связаны с изучением металлов, их свойств, с изучением их возможностей, а значит со знанием таблицы Менделеева, с которой мы знакомимся еще в школьные годы на уроках «Химии». С развитием производства металлов (простых веществ) и сплавов связало возникновение цивилизации («бронзовый век», железный век). Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до 3000 ºС. в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония. |
|
3.2. Ситуация оценки образовательных результатов |
Формулируется проблемный вопрос, для домашнего задания, выставляются оценки за урок. Комментирует отметки, указывает на достижения и недоработки обучающихся. Побуждает к анализу индивидуальных достижений.
«что понравилось», «что не понравилось». |
Анализ достижения цели урока. Подведение итогов урока (заполнение рабочей карточки урока ) |
ПРИЛОЖЕНИЯ
Приложение 1
Рабочая карта урока
Урок ________________ Класс _____________ Дата ______________
Тема ______________________________________________________
Цель ______________________________________________________
|
Фамилия, имя ученика |
с/о собран-ности и внимания в начале урока |
Проверка домашнего задания (с/о или в/о) |
Изучение нового материала (с/о) |
Закрепление нового материала |
Подведение ито-гов |
||||||
|
с/о внима ния |
в/о крос-сворда |
с/о заданий |
с/о внима ния |
с/о контро-льных вопро-сов |
с/о опреде-ления цели урока |
с/о пони-мания темы урока |
с/о внимания |
с/о отве-тов на вопро-сы |
Итоговая с/о |
||
|
1. |
|||||||||||
|
2. |
|||||||||||
|
3. |
|||||||||||
|
4. |
Примечание: с/о – самооценка; в/о – взаимооценка; о/г – оценка группы.
Приложение 2
Лабораторная работа (Инструкция)
«Исследование физических свойств оксидных руд железа»
!!! Помним и соблюдаем правила техники безопасности.
1. Внимательно рассмотрите образец коллекции, выданный под номером.
2. Обратите внимание на внешний вид образцов , определите цвет и блеск,
свои наблюдения запишите в таблицу
3. Возьмите фарфоровую ступку и куском руды нанесите на ее поверхность черту. Исследуйте какой след оставляют образцы на фарфоре, наблюдения занесите в таблицу
4. Протестируйте выраженность магнитных свойств образцов, для этого поднесите кусок руды к компасу. Откланяется ли стрелка компаса? Если да, то велико ли отклонение? Наблюдения занесите в таблицу
5. Обсудите результаты в группе, сделайте вывод, запишите в лист наблюдений
Лист наблюдений
Лабораторная работа
«Исследование физических свойств оксидных руд железа».
|
Наименование руды, формула рудообразующего оксида железа |
Окраска и блеск |
Цвет черты на фарфоре |
Магнитные свойства |
|
1.Магнитный железняк Fe3O4 |
|||
|
2. Красный железняк Fe2O3 |
|||
|
3. Бурый железняк Fe2O3*nH2O |
Вывод
Приложение 3
Доклад
От руды к чугуну
Цель доклада – доменный процесс или получение чугуна из железа. Металлическое железо добывают в настоящее время из руды. наиболее важная руда – магнитный железняк или магнетит, так как там самый высокий процент содержание железа. эту руду сегодня мы рассматривали в лабораторной работе. Большие глыбы руды сначала подвергают измельчению. Пустая порода таких руд непроизводительно обременяют доменную печь и затрудняют восстановительный процесс и выплавку. поэтому руду предварительно обогащают с помощью метода флотации или пиротехнических методов. После этого из руды получают чугун, то есть осуществляют восстановительный процесс, где восстановителем выступает углерод. Этот процесс проводят в доменной печи или домне. Это мощная шахтная печь высотой от 20 до 35 метров, состоящая из двух усеченных конусов. Загрузка домны осуществляется сверху с колошниковой площадки. В очаге, находящемся в нижней части горна, собирается жидкий чугун. Чтобы его спустить через каждые 4, 6 часов открывают отверстие, находящееся под полом печи и закрытое глиняной пробкой. Внутри доменной печи протекают следующие реакции восстановления руды с образованием чугуна:
Fe2O3 


69,9% 72,3% 77,7% 100%
Таким образом, производство чугуна – первый этап в металлургии железа. Облагораживание чугуна с образованием стали представляет собой очень важный второй этап производства
От чугуна к стали
Цель доклада – рассмотреть процессы получения стали из чугуна.
Чугун – это сплав, который отличается многими неблагоприятными свойствами, вызванными загрязнением железа примесями углерода и других веществ. Понижение содержания углерода от 4% до 0,5% превращает чугун в упругую вязкую массу – сталь. Методы, применяемые для производства стали из чугуна, разделяют на переделку чугуна путем продувки в конвертере и на переделку чугуна в кричном горне (мартеновской печи), применяемую в методе Сименса- Мартена. Конвертеры представляют собой грушеобразные сосуды, которые могут быть приведены во вращение вокруг их оси. Высота конвертера приблизительно 8 метров, вместимость приблизительно 40 тонн чугуна. Заполнив «грушу» чугуном, конвертер заполняют воздухом, продувая металл. Примеси: углерод, марганец, кремний, под влиянием кислорода сгорают, образуются газообразные оксиды, которые отводятся через газообразную трубу, при этом сгорает некоторое количество железа. Через 20 минут, большая часть примесей оказывается удаленной из металла. Лишь фосфор и сера удаляются в незначительных количествах. Чугун, богатый фосфором, перерабатывают также в конвертерах, но Томасовским способом.
Основное количество стали получают мартеновским способом. Процесс происходит в особых печах, называемых пламенными регенеративными мартеновскими печами. В плавильную печь загружают чугун, железный лом, чистую руду, известь. Температура в печи 1800 градусов. Шихта плавится, происходит окисление углерода и примесей. В мартеновской печи легко получают легированные стали.
Легированные стали выплавляются обычно в особых электрических печах при температуре свыше 3000 градусов. Это дуговые электросталеплавильные печи, способ электротермический, применяется для получения сталей, содержащих тугоплавкие металлы.
ИТОГОВАЯ РАБОТА СЛУШАТЕЛЯ курсов повышения квалификации
Сценарий учебного занятия по предмету
Сведения об авторе |
|
|
Фамилия, имя, отчество (полностью) |
Соколова Ирина Михайловна |
|
Район |
Шахунский |
|
Место работы |
МБОУ Красногорская ООШ |
|
Должность |
Учитель биологии, химии |
Общая информация |
|
|
Образовательная область, учебный предмет |
химия |
|
Класс |
9 класс |
|
Авторская программа к учебникам (линии учебников или УМК) (если есть) |
Г. Е. Рудзитес |
|
Тема учебного занятия |
Изучение влияния условий проведения химической реакции на ее скорость. |
|
Тема урока или другой формы организации УВП: экскурсия, консультация, проект, лабораторное занятие, практикум, игра и т.п. |
Проектно-исследовательский урок.
|
|
Место урока или другой формы организации учебной деятельности в структуре учебного занятия |
Раздел 1 — Химические реакции (15 часов) |
|
Учебная задача
|
|
Обобщенные цели учебного занятия — планируемые результаты |
||
|
Цель Уровень |
Базовый («обучающийся научится») |
Повышенный («обучающийся получит возможность научиться») |
|
Цель – предмет (предметный результат) |
Обучающиеся научатся объяснять влияние разных факторов на скорость химических реакций. |
Обучающиеся получат возможность оценивать значимость химических процессов протекающих в природе, оценивать их значимость на Земле, также для всех живых организмов. |
|
Цель – способ (метапредметный результат) |
Обучающиеся научатся самостоятельно планировать пути достижения целей, осознанно выбирать наиболее эффективные способы решения поставленных задач. Совершенствовать экспериментальные умения в проведении химического эксперимента. |
Обучающиеся получат возможность ранжировать и обосновывать зависимость скорости реакций от разных факторов. |
|
|
Цель – ценность (личностный результат) |
Обучающиеся научатся оценивать ситуацию и оперативно принимать решение, находить адекватные способы взаимодействия с одноклассниками во время проведения практической работы. |
Обучающиеся получат возможность для формирования оценки химических процессов, происходящих в природе в живых организмах. Провести экспертизу состояния живых организмов. Высказать критические суждения о процессах жизнедеятельности клетки. Присутствие фермента – Каталазы в клетках живых организмов и ее роли для биохимических процессов (позиции, понимания, убеждения, установки, оценки и т.п.) |
|
|
Исходное состояние обучающихся: — имеют опыт…….; — знают (факты, процессы, явления, понятия, теории и т.д.) — могут определять…….; — могут сравнивать, доказывать, аргументировать, сопоставлять; — могут планировать, проектировать, моделировать; — могут контролировать, оценивать и т.д. |
Обучающиеся 9 класса имеют опыт работы с лабораторным оборудованием, с реактивами, нагревательными приборами приобретенные в 8 классе. Знают правила по технике безопасности. Знают теорию о скорости химических реакций, о катализе и катализаторах, о ферментах, об ингибиторах. Могут определять типы химических реакций и их признаки. Могут сравнивать разные типы химических реакций, аргументировать и доказывать их принадлежность к определенному типу. Могут составлять химические формулы веществ и давать им названия. Могут подбирать коэффициенты в уравнениях химических реакций. Могут находить основные части растительной клетки на микропрепаратах и таблицах, могут схематически изображать строение клетки, могут сравнивать клетки растений и животных, находить их сходства и отличия, могут моделировать клетку из пластилина, Могут выполнять проекты. Могут составлять небольшой план рассказа или излагать материал по плану. Могут оценивать по определенным критериям, предложенным учителем (самооценка и взаимооценка) Могут контролировать время своей работы на уроке в соответствии с регламентом урока. |
||
|
Формы оценки планируемых результатов |
Предметный результат |
Метапредметный результат |
Личностный результат |
|
Оценка по критериям (слайд презентации) Работают с основным, дополнительным и пояснительным текстовым компонентами. |
Находят в тексте (п.4 и инструктивные карточки 1,2,3,4,5,6) модели, схемы Интерпретируют текстовую информацию в виде уравнений химических реакции, записывают формулы веществ, подбирают коэффициенты, заполняют в таблицу свои наблюдения, формулируют выводы проделанной работе. |
Разрабатывают и предлагают свои критерии |
|
Комментарии учителя к учебному занятию или уроку |
Наш урок прошёл интересно, увлекательно!? Ромашка «Блума» |
Что понравилось, где были затруднения. |
Учащиеся выставляют оценку своей работе, анализируют её. Указывают цвет настроения на полях тетради. |
Учебно – информационное и техническое обеспечение учебного занятия |
||||
|
Учебное – информационное обеспечение |
Основная литература |
Дополнительная литература |
Интернет — ресурсы |
ЭОРы |
|
Химия 9 класс Г. Е. Рудзитис Москва. Просвещение, 2019г. |
Текст: «Фермент — Катлаза) |
Открытый урок |
||
|
Техническое обеспечение |
Компьютер, мультимедийный проектор |
Дидактическая структура учебного занятия (урока) и его психолого – педагогическое обоснование |
||||
Этап урока |
Под этап урока |
Организация педагогически целесообразного взаимодействия (описываются конкретные методы и приемы, которые использует учитель на каждомпод этапе урока) |
Психолого – педагогическое обоснование (представляется смысловая характеристика организуемого образовательного процесса с точки зрения его соответствия требованиям развития обучающихся на конкретной ступени общего образования и педагогической концепции, на которой основывается деятельность учителя) |
|
|
1.Мотивационно ориентировочный |
1.1. Вхождение в контакт |
|
Создание комфортной психологической атмосферы урока |
|
|
1.2. Актуализация субъектного опыта обучающихся |
|
Переживание успешности практического действия, подтверждение значимости позиции ученика. |
||
|
1.3. Создание проблемной ситуации (конструктивного конфликта «знания – не знания», «умения – неумения», «понимания – не понимания» |
|
Создание проблемной ситуации – это новый поворот в уже знакомом материале, озадачивая. Разрыв непрерывности предметного действия, переживание невозможности дальнейшего движения требует обсуждения сложившейся ситуации. Выход из нее – определение задачи: «мы не знаем решения, но восстанавливаем путь, знаем, куда идти». Здесь возникает учебно-познавательный мотив, направляющий мыслительную деятельность обучающихся |
|
2. Операционно – исполнительский |
2.1. Целеполагание и планирование |
|
Непосредственная постановка ученика в позицию субъекта целеполагания и планирования путем конструирования цели и плана с помощью заданных алгоритмов, представляющих цель в виде гипотезы, предположения, контура, который будет уже в процессе деятельности обрастать “плотью” |
|
|
2.2. Поиск способа решения проблемной ситуации |
|
Осуществление данного этапа учебной деятельности связано с содержательным анализом предметного материала, который направлен на поиск и выделение в целостном предмете основного и генетически исходного отношения |
||
|
2.3. Выбор верного варианта решения, фиксация найденного способа |
|
Действие моделирования направлено на отделение содержания от формы с помощью знаково – символических средств представления этого содержания, что выступает существенным показателем понимания учащимися учебной задачи. В действии преобразования модели осуществляется переход от чувственного конкретного представления об исследуемом объекте к получению собственного знания о нем |
||
|
2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий |
|
В психологическом плане на этом этапе происходит интериоризация способа деятельности, а также очерчиваются границы его применимости |
||
|
3. Рефлексивно – оценочный |
3.1. Ситуация контроля за выполнением учебных действий |
|
Установление адекватности выбранной системы действий условиям учебной задачи — учащиеся анализируют правильность и полноту реализуемых действий в ходе решения учебной задачи |
|
|
3.2. Ситуация оценки образовательных результатов |
|
Осмысление процесса решения учебной задачи, ее предметных оснований, а также своих способностей к осуществлению данного рода учебных действий, усвоения их принципов построения |
Сценарий проведения учебного занятия |
|||
Этап урока или другой формы УВП |
Подэтап урока или другой формы УВП |
Действия учителя (педагога) |
Действия обучающихся(примерные версии ответов) |
|
1.Мотивационно ориентировочный |
1.1. Вхождение в контакт |
-Уважаемые коллеги! Нет, не, т я не оговорилась. Сегодня вы не учащиеся 9 класса, а мои коллеги химики, экспериментаторы, исследователи. -Надеюсь, что наш урок пройдет интересно и увлекательно. -Предлагает перед началом урока поставить перед собой цель-оценку, которую учащиеся хотят получить в конце урока. |
Проверяют свою готовность к уроку, концентрируют внимание.
|
|
1.2. Актуализация субъектного опыта обучающихся |
-Что вы знаете о химических реакциях? -Сформулируйте определение химические реакции -Какие признаки химических реакций вы знаете? -Назовите химические явления, происходящие в природе и назовите их признаки. |
Отвечают на вопросы учителя. Высказывают свои наблюдения, приводят примеры химических явлений, называют признаки химических реакций, формулируют определение. |
|
|
1.3. Создание проблемной ситуации |
-Скажите, пожалуйста, любите ли вы сок? После вскрытия упаковки сок рекомендуют сразу употребить. Но бывает так, что он остается, стоит дня 2-3. В итоге сок начинает бродить и приобретает неприятный запах. — О чем это свидетельствует (с точки зрения химии)? -Какие признаки химических реакций наблюдаются при этом? Но бывает так, что сок может простоять без изменений, и признаков порчи не наблюдается. — Значит ли это, что химические реакции не протекают? -Или протекают очень медленно? Химические реакции протекают с разной скоростью? |
Слушают учителя. Отвечают на вопросы. Формулируют тему урока. Сегодня нам предстоит ознакомиться с понятием «скорость химической реакции» и узнать, от каких факторов она зависит. |
|
|
2. Операционно – исполнительский |
2.1. Целеполагание и планирование |
ОБРАЩЕНИЕ К РЕБЯТАМ (слайд презентации) Работа парная, поэтому вы до урока определили свой выбор для сотрудничества. «Целое больше простой суммы чисел», это слова Аристотеля. А.А. Богданов в подтверждении этого теоретического положения писал: «Элементарное сотрудничество, соединение одинаковых сил, какой-нибудь работы, может вести к возрастанию практических результатов в большей пропорции, чем количество сил». Переходим к практической части урока. Повторяем правила по Т.Б. (слайды презентации) Перед каждым опытом озвучивают гипотезу Выводы рекомендуется записывать после каждого проделанного опыта. ЖЕЛАЮ УСПЕХА! Приложение Выполнить практическую часть урока. Сформулируем выводы, выполнить проект. Оценить свою работу. Давайте совместно составим план урока. (слайд презентации) |
|
|
2.2. Поиск способа решения проблемной ситуации |
ЭПИГРАФ (слайд презентации) «Химии никоим образом научиться не возможно, не видав самой практики и не принимаясь за химические операции» М.В. Ломоносов За выполнением практической части следит учитель (соблюдение правил по Т.Б.) Проделайте опыты, зафиксируйте их записями в ваших проектах. |
Объясняют слова ученого. Выполняют практическую часть урока. |
|
|
2.3. Выбор верного варианта решения, фиксация найденного способа |
Обсудите в паре и заполните таблицу в тетрадях. Оформление работы и будет вашим мини-проектом. |
Оформляют работу в тетрадях для практических работ. Записывают уравнения химических реакций, обсуждают в парах, формулируют и записывают выводы. |
|
|
2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий |
Каждая пара выполнила практическую часть. Послушаем выступления моих коллег химиков – исследователей. Вопросы для обсуждения в паре 1.Как изменится скорость химической реакции, температурный коэффициент которой 3, при повышении температуры с 10ºС до 40ºС? 2. Вы знаете, что если в помещении пожар, нельзя открывать окна. Почему? Значит, увеличивается скорость реакции горения. — За счет чего увеличивается скорость горения? 3. Вы наверняка когда-нибудь растапливали камин или печь, ходили в походы, разжигали костры. Какие брали дрова для костра – крупные поленья или хворост? — Как вы думаете, почему? Решают задачу по формуле. 4.От каких факторов зависит скорость химической реакции? 5.Запишите правило Вант-Гоффа 6. Скорость химической реакции это? 7 . Наблюдалось ли разогревание реакционной массы в каком-либо из опытов Критерии оценивания (слайды презентации). Тетради для практических работ передайте учителю. Итоговая оценка будет выставлена в тетради после проверки ваших письменных отчетов. |
Выступления учащихся. Обсуждают вопросы в паре и выступают, аргументируя и доказывая свою точку зрения. Отвечают на вопросы. |
|
|
3. Рефлексивно – оценочный |
3.1. Ситуация контроля за выполнением учебных действий |
ЭПИГРАФ (слайд презентации) «Я слышу — я забываю, я вижу – я запоминаю, я делаю – я понимаю» |
Цитируют и объясняют эпиграф. Самооценка и взаимооценка работы на уроке. Критерии на слайде презентации. |
|
3.2. Ситуация оценки образовательных результатов. -Применяя те или иные методы и приемы активизации, необходимо всегда учитывать имеющийся уровень развития познавательных способностей обучающегося. -Сложные познавательные задачи можно предъявлять лишь ученикам, обладающим высоким уровнем развития познавательных способностей. -Задачи, не соотнесенные с уровнем развития познавательных сил обучающихся, превышающие возможности ученика, предъявляющие к нему требования, значительно опережающие умеющего у него развития не могут сыграть положительную роль в обучении. Они подрывают у обучающихся веру в свои силы и способности. |
Предлагалось перед началом урока поставить перед собой цель-оценку, которую учащиеся хотят получить в конце урока. Совпали оценки в начале урока и в конце? Достигли вы цели? Что нужно выполнить дома?
|
спрашивают, задают вопросы по его выполнению.
Устно высказывают свое мнение
|
Сценарий проведения учебного занятия |
|||
Этап, под этап урока урока или другой формы УВП |
Метапредметные -Познавательные -Регулятивные -Коммуникативные |
Предметные |
Личностные |
|
1.Мотивационно ориентировочный |
К-планирование учебного сотрудничества с учителем и сверстниками (слушают и вступают в диалог) Р — планирование этапов выполнения работы, поиск необходимых ресурсов П — Самостоятельно определяет необходимость и целесообразность проведения логических операций в соответствии с учебной задачей. Комментируют данную проблему. Выдвигают гипотезу. |
Пр. — Определения понятий: химия, химические и физические явления, признаки химических реакций, важные условия проведения химических реакций, атомы, молекулы, сложные и простые вещества, химическое уравнение, формула веществ, индекс, коэффициенты, типы химических реакций |
Л-мотивация Установление связи между целью учебной деятельности и ее мотивом — определение того, «какое значение, смысл имеет для меня учение». Оценка уровня притязаний |
|
2. Операционно – исполнительский |
К — управляют поведением партнёра (интегрироваться в группу сверстников и строят продуктивное взаимодействие и сотрудничество со сверстниками и взрослыми). Выражать свои мысли с достаточной полнотой и точностью в соответствии с задачами и условиями коммуникации. Представляют в виде связанного текста процессы, проделанных опытов. Объясняют, на основе проведенных исследований о результатах опытов. Р — планирование этапов выполнения работы. Отслеживание продвижения в выполнении задания, прогнозируют, ориентируются в ситуации. П-Самостоятельно определяет необходимость и целесообразность проведения логических операций в соответствии с учебной задачей. Самостоятельно устанавливает причинно-следственные связи, аргументировано объясняет наблюдаемые и изучаемые явления. Выделяет основную идею и контекст, выстраивает последовательность описанных событий, использует информацию из предложенного текста. Предлагают аргументированный вывод на основе критического анализа текста, сопоставления различных точек зрения. Самостоятельно составляют письменный отчет, представляют информацию в наглядной форме. |
Пр. — окислительно — восстановительные реакции, экзотермические и эндотермические реакции, тепловой эффект реакции термические уравнения, скорость химической реакции, катализаторы, катализ, ингибиторы, ингибирование. |
Л — нравственно-этическая оценка Выделение морально-этического содержания событий и действий. Построение системы нравственных ценностей как основания морального выбора. (Методика ЦОЛ) Нравственно-этическое оценивание событий и действий с точки зрения моральных норм. Ориентировка в моральной дилемме и осуществление личностного морального выбора. Ориентация в социальных ролях и межличностных отношениях. |
|
3. Рефлексивно – оценочный |
К — участвуют в постановке вопросов К-умение с достаточной полнотой и точностью выражать свои мысли (высказывают свои аргументированные критические суждения по данному вопросу, приводят аргументы «за»). Оцените значимость дальнейших научных исследований в данной области. Р- оценивают реальность проекта П — Самостоятельно работают критериям, сравнения. |
Пр. – я знаю какие факторы влияют на скорость химических реакций |
Л — внутренняя позиция Я знаю… Я умею… Я создаю… Я стремлюсь… Оценка уровня притязаний Жизненное, личностное, профессиональное самоопределение |
|
УУД |
Образовательные результаты |
ГИА выпускника |
|
личностные |
личностные |
Не подлежат оцениванию |
|
познавательные |
метапредметные |
подлежат оцениванию |
|
регулятивные |
||
|
коммуникативные |
||
|
предметные |
подлежат оцениванию |
|
КОММУНИКАТИВНЫЕ УУД |
|
|
слушать и вступать в диалог |
выскажите свои аргументированные критические суждения по данному вопросу какие аргументы «за» вы можете привести в плане использования… |
|
интегрироваться в группу сверстников и строить продуктивное взаимодействие и сотрудничество со сверстниками и взрослыми |
оцените значимость дальнейших научных исследований в данной области. проведите виртуальную экскурсию для учащихся 9 класса. |
|
выражать свои мысли с достаточной полнотой и точностью в соответствии с задачами и условиями коммуникации. |
представьте в виде связанного текста явления и процессы проведенных опытов Скажите, пожалуйста, любите ли вы сок? После вскрытия упаковки сок рекомендуют сразу употребить. Но бывает так, что он остается, стоит дня 2-3. В итоге сок начинает бродить и приобретает неприятный запах. — О чем это свидетельствует (с точки зрения химии)? -Какие признаки химических реакций наблюдаются при этом? прокомментируйте выражение применительно к данной проблеме. объясните, почему на основе проведенных исследований в термически обработанных продуктах нет фермента- Каталазы. |
|
РЕГУЛЯТИВНЫЕ УУД |
|
|
планирование этапов выполнения работы поиск необходимых ресурсов |
составьте мультимедийную презентацию по теме «Изучение влияния условий проведения химической реакции на ее скорость» |
|
планирование этапов выполнения работы |
составление плана урока, позволяющего добиться поставленной цели посредством решение учебных задач. |
|
отслеживание продвижения в выполнении задания |
насколько выгодно использовать практическую часть урока. |
|
на прогнозирование |
напишите возможный гипотезы перед началом каждого опыта (эксперимента) |
|
на ориентировку в ситуации |
назовите ваши действия или мероприятие, позволяющее ликвидировать пробелы знаний по данной теме. |
|
на оценивание |
оцените рентабельность своего проекта |
|
ПОЗНАВАТЕЛЬНЫЕ действия постановки и решения проблем |
|
|
самостоятельное создание способов решения проблем творческого и поискового характера |
каким образом могут быть изменения условия химических реакций, чтобы изменить их скорость (увеличить или уменьшить) |
|
исследование, поиск и отбор необходимой информации, ее структурирование; |
Исследуйте таблицу №1 (ст. 14), преобразуйте текстовую информацию в виде схем и уравнений реакций |
|
моделирование изучаемого содержания, |
Смоделируйте уравнения реакций в молекулярном и структурном виде |
|
логические действия и операции, |
Выработайте матрицу последовательных действий в написании химических уравнений |
|
способы решения задач |
Предложите два варианта решения расчетной задачи с выделением газа. |
|
ЛИЧНОСТНЫЕ УУД |
|
|
жизненное, личностное, профессиональное самоопределение |
выскажите свои аргументированные критические суждения по данному вопросу |
|
действия смыслообразования и нравственно-этического оценивания, реализуемые на основе ценностно-смысловой ориентации учащихся (знания моральных норм, умения выделить нравственный аспект поведения и соотносить поступки и события с принятыми этическими принципами) |
оцените значимость дальнейших научных исследований в данной области. какие аргументы «за» вы можете привести в плане использования… какую роль играет химическая наука в разработке способов изоляции радиоактивных отходов? используя дополнительные источники информации, выясните, какое влияние на организм человека оказывают приведенные в тексте компоненты табачного дыма |
|
ориентация в социальных ролях и межличностных отношениях. |
представьте, что вы директор предприятия, изображенного на рисунке… представьте, что вам пришлось разработать анкету для населения |
Приложение №1
Фермент — Каталаза
Биологические катализаторы белковой природы называют ферментами. Каталаза – фермент, обнаруженный почти во всех живых организмах: тканях растений, животных, и в микроорганизмах. В клетках Каталаза содержится в пероксисомах. Основная его функция – катализировать реакцию разложения перекиси водорода до безвредных для организма веществ. Каталаза имеет большое значение для жизнедеятельности клеток, так как защищает их от разрушения активными формами кислорода.
-
История открытия Каталаза не была известна ученым до 1818 года, пока Луи Жак Тенар, химик обнаруживший в живых клетках перекись водорода, не предположил, что ее разрушение связано с действием ранее неизвестного биологического вещества.
-
Катализ перекиси водорода. Несмотря на то, что пероксид водорода – продукт многих нормальных метаболических процессов, для организма он не является безвредным. Чтобы предотвратить разрушение клеток и тканей, перекись водорода должна быть быстро превращена в другое, менее опасное для организма вещество. Именно с этой задачей и справляется фермент каталаза — он разлагает две молекулы перекиси до двух молекул воды и молекулы кислорода. Реакция разложения пероксида водорода в живых тканях:
2 H 2O2 → 2 H 2O + O 2
Механизм расщепления перекиси водорода ферментом
каталазой пока точно не изучен.
Каталаза разрушается в клетках и тканях под воздействием высоких температур при термической обработке.
Приложение №2
Вспомните правила техники безопасности при выполнении химического эксперимента (слайды презентации)
-
Многие вещества при попадании на кожу могут вызвать ожоги. Никогда не берите вещества руками.
-
Некоторые вещества имеют неприятный запах, а их пары могут вызвать отравление. Не подносите близко к лицу открытую склянку.
-
В химической лаборатории не пробуют на вкус даже известные вещества, они могут содержать примеси, ядовитые для человека.
-
Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
-
Если кислота или щёлочь попала на кожу, её надо немедленно промыть большим количеством проточной воды.
-
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
-
Зажигать спиртовку только спичками, гасить крышкой или колпачком, накрывая сверху.
-
Запрещается передавать зажжённую спиртовку и зажигать одну спиртовку от другой.
-
При нагревании вещества в пробирке её необходимо сначала прогреть, отверстие пробирки во время нагревания должно быть направлено от себя и соседа.
-
Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
-
Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
-
Опыты проводить с таким количеством веществ, которые указаны в методическом руководстве по проведению каждого опыта.
-
Без разрешения учителя, ничего на столах не трогать.
-
Во время проведения эксперимента или оформлении отчёта соблюдайте тишину.
-
После работы приведи порядок на рабочем месте.
Расписываемся в журнале по Т.Б.
Прочитайте инструкцию по выполнению работы п. 4 ст.16
Приложение №3
ОБРАЩЕНИЕ К РЕБЯТАМ
Работа парная, поэтому вы до урока определили свой выбор для сотрудничества.
«Целое больше простой суммы чисел», это слова Аристотеля.
А.А. Богданов в подтверждении этого теоретического положения писал: «Элементарное сотрудничество, соединение одинаковых сил, какой-нибудь работы, может вести к возрастанию практических результатов в большей пропорции, чем количество сил».
Переходим к практической части урока. Перед каждым опытом озвучивают гипотезу
Выводы рекомендуется записывать после каждого проделанного опыта ЖЕЛАЮ УСПЕХА!
ОПЫТ 1
Влияние природы реагирующих веществ
1)В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую – кусочек цинка, в третью- кусочек меди. Что наблюдаете? Какая реакция протекает быстрее?
2)Налейте в одну пробирку соляную кислоту, а в другую уксусную, в каждую пробирку опустите по одной грануле цинка. Определите какая реакция происходит интенсивно? И почему?
ОПЫТ 2
Влияние концентрации реагирующих веществ
В две вробирки поместите по одной грануле цинка, в одну пробилку прилейте 1 мл соляной кислоты 30%, а в другую 1 мл 10% соляной кислоты. Где более интенсивно проходит реакция?
ОПЫТ 3
Влияние поверхности соприкосновения реагентов
В одну пробирку опустите кусочек мела, а в другую насыпьте немного порошка мела. Налейте к пробиркам 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
ОПЫТ 4
Влияние температуры
В две пробирки опустите по одной грануле цинка. Налейте в каждую по 1 мл соляной кислоты. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделение водорода в пробирках и сделайте
ОПЫТ 5
Влияние катализатора
В одну пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку. Что наблюдаете? Добавьте в пероксиду водорода оксид марганца (IV) и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет оксид марганца (IV)?
Приложение №4
ОПЫТ 6
Обнаружить действие фермента каталазы в растительных и животных клетках, сравните ферментативную активность натуральных и поврежденных кипячением клеток.
Оборудование: штатив с пробирками, салфетка, стеклянная палочка, 3% раствор пероксида водорода, картофель, свежий и отварной, мясо свежее и отварное, зеленый лист растения.
Ход работы:
1) Возьмите чистые пробирки и поместите в первую из них мелко нарезанного отварного картофеля, во вторую кусочки измельченного отварного мяса, в третью кусочки сырого картофеля, в четвертую кусочки измельченного сырого мяса, в пятую части листа растения. В каждую пробирку добавьте 3-4 мл. 3% раствора пероксида водорода. Понаблюдайте, что происходит в пробирках? Результаты наблюдений и объяснения занесите в таблицу.
2) Отчет о проделанной работе оформите в виде таблицы
|
№ пробирки, Предмет исследования |
Наблюдения |
Объяснения |
|
1. |
||
|
2. |
||
|
3. |
||
|
4. |
||
|
5. |
3)Обсудите в парах
Чем можно объяснить сходство явлений в опыте с сырым картофелем и сырым мясом? В каких опытах ферментативная активность каталазы больше в растительных или животных тканях, в натуральных или поврежденных кипятком клетках?
4) Запишите выводы о приделанной работе, напишите уравнение реакции получения кислорода разложение пероксида водорода, укажите условия этой реакции.
Вопросы для обсуждения в паре
1.Как изменится скорость химической реакции, температурный коэффициент которой 3, при повышении температуры с 10ºС до 40ºС?
2. Вы знаете, что если в помещении пожар, нельзя открывать окна. Почему? Значит, увеличивается скорость реакции горения. — За счет чего увеличивается скорость горения?
3. Вы наверняка когда-нибудь растапливали камин или печь, ходили в походы, разжигали костры. Какие брали дрова для костра – крупные поленья или хворост? — Как вы думаете, почему?
Решают задачу по формуле.
4.От каких факторов зависит скорость химической реакции?
5.Запишите правило Вант-Гоффа
6. Скорость химической реакции это?
7 . Наблюдалось ли разогревание реакционной массы в каком-либо из опытов
ОЦЕНКА:
(За практическую часть)
(За письменную часть)
( Итоговая)
Вывод: ___________________________________
(Сформулируйте вывод из цели работы)
Рефлексия:
Чему научился, что понравилось и получилось, в чем испытали затруднения???
Д/З:
-
Используя Конструктор задач Илюшина (любую колонку на ваш выбор 1-2-3-4-5). Составьте вопросы и запишите ответы.
Проведите эксперимент №6 в домашних условиях (оборудование: небольшие емкости, перекись Сложные познавательные задачи можно предъявлять лишь ученикам, обладающим высоким уровнем развития познавательных способностей.
-
водорода)
Исследуйте грибы, рыбу…термически обработанные и свежие или свежемороженые. Предложите новые варианты исследования. Отчеты оформите в виде таблицы.
-
П.3-4 определения выучить, таблица 1 (условия, примеры-по возможности составить самим с помощью Интернет-ресурсов.)
-
Подготовьте доклад-сообщение о французском химике (Берналле Клад Луи).
Ребята, закончить урок
хочу словами Эммануила Канта:
«Без сомнения все наши знания начинаются с опыта»
Приложение №5
Конструктор задач (Л.С. Илюшин)
ПРИМЕРНЫЕ ЗАДАНИЯ ПО Конструктору задач (Л.С. Илюшин)
-
назовите основные определения по данной теме: химия, химические и физические явления, признаки химических реакций, важные условия проведения химических реакций, атомы, молекулы, сложные и простые вещества, химическое уравнение, формула веществ, индекс, коэффициенты, типы химических реакций
-
структурируйте вместе все понятия, которые нужны для изучения влияния условий на скорость химических реакций
-
составе список понятий, касающихся темы скорость химических реакций и влияние условий на ее скорость
-
расположите в определенном порядке увеличение основных металлов (натрий, алюминий, кальций, медь, железо)
-
изложите в форме текста о химических реакциях, происходящих в природе
-
вспомните и напишите о роли ферментов в биохимических реакциях, на примере фермент а- Каталазы
-
прочитайте самостоятельно на ст. 14 инструкцию о проведении опытов
-
объясните причины увеличения скорости реакции при изменении условий
-
обрисуйте в общих чертах шаги, необходимые для выполнения химического эксперимента, шаги для написания химического уравнения
-
покажите связь, которые направлены на зависимость свойств металлов и их положение в периодической таблице
-
постройте прогноз развития
-
постройте прогноз развития «Парникового эффекта» на Земле
-
прокомментируйте положение о том, что свойства веществ зависят от их строения
-
приведите примеры взаимодействия металлов разной химической активности со сложными веществами(вода, кислота, соль);
-
изобразите информацию об изменении скорости химической реакции от температуры в виде графика(вспомните правило)
-
предложите способы позволяющие, как можно дольше сохранить продукты питания
-
сделайте эскиз-рисунок-схему химического процесса, который отражает химическое явление, проходящее в природе(конденсация, испарение, сублимация)
-
сравните и обоснуйте результаты своих исследований (п.19)
-
разработайте и проведите эксперимент о наличии фермента — Каталазы в тканях живых организмов (растений, грибов, лишайников, животных)
-
проведите презентацию о влиянии условий на скорость химических реакций
-
раскройте на основании проведенных опытов влияние условий на скорость химических реакций
-
раскройте особенности влияния поверхности соприкосновения реагентов
-
проанализируйте с точки зрения атомно молекулярного учения химическую реакцию одного из выполненных вами опыта
-
составьте перечень основных (физических и химических) свойств металлов, характеризующих их окислительно-восстановительные свойства
-
постройте классификацию кислот на основании окислительно восстановительных свойств
-
найдите в тексте схемы, модели, указывающие на химическое явление, признаки химического процесса
-
сравните точку зрения свою и соседа по парте
-
выявите принципы, лежащие в основе атомно молекулярного учения
-
предложите новый иной вариант изучения влияния условий на скорость химических реакций
-
раскройте план, позволяющий выявить особенности проведения химических реакций и влияния условий на их протекание
-
найдите необходимые способы, позволяющие уменьшить скорость некоторых химических реакций, наносящих вред природе и человечеству
-
придумайте игру, которая раскроет основные понятия данной темы
-
предложите новую (свою) классификацию химических реакций
-
напишите возможные (наиболее вероятные) сценарии развития изменения озонового экрана , защищающего Землю от воздействия ультрафиолетовых лучей
-
изложите в форме схемы своё мнение
-
ранжируйте и обоснуйте условия, влияющие на скорость химической реакции
-
определите, какое из решений на ваш взгляд является оптимальным для сохранения сока
-
оценит значимость химических реакций в природе и значимость биохимических реакций для живых организмов
-
определите возможные критические оценки о замороженных и термически обработанных продуктах
-
выскажите критическое суждение о скорости химических реакций и влияние условий на их скорость
-
оцените возможности дляизучение влияния условий проведения химической реакции на ее скорость.
-
проведите экспертизу состояния проектной работы своего коллеги (соседа по парте)
проведите экспертизы состояния (в домашних условиях) домашних продуктов на наличие фермента-Каталазы
Г
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/483724-plankonspekt-uroka-po-himii-v-9-klasse
Сценарий учебного занятия по дисциплине
«Административное право»
Автор: Шевченко Олеся Павловна
Организация: БПОУ ОО ОПЭК
Населенный пункт: Омская область, г. Омск
План проведения занятия
|
Преподаватели |
Шевченко Олеся Павловна |
|
Дисциплина |
Административное право |
|
Дата проведения |
|
|
Специальность |
40.02.01 Право и организация социального обеспечения |
|
Группа |
КПС — 157 |
|
Курс |
Первый |
|
Тема |
Административная ответственность, правонарушение и меры наказания |
|
Вид занятия |
Изучение нового материала |
|
Тип занятия |
комбинированное |
Цели занятия
Обучающие:
- Закрепить знания, полученные ранее по дисциплинам специального цикла Трудовое право, Уголовное право, Гражданское право по темам: Виды юридической ответственности.
- Совершенствовать знания по теме: Административная ответственность, правонарушение и меры наказания.
- Совершенствовать навыки работы с нормативными правовыми актами (КоАП РФ).
Развивающие:
- Формировать познавательную активность у студентов.
- Развивать правовую грамотность, профессиональную и общую культуру у студентов.
- Формировать навыки выполнения индивидуальной и коллективной работы, правильного коммуникативного общения.
Воспитательные:
- Воспитание специалиста, понимающего сущность и социальную значимость будущей профессии.
- Воспитание чувства профессиональной ответственности за результат своего труда.
- Воспитание личностные качества: самостоятельность в принятии решений при выполнении разного рода заданий, дисциплинированность, добросовестное отношение к выполняемой работе.
Междисциплинарные связи
Параллельные дисциплины:
Теория государства и права
Трудовое право
Уголовное право
Гражданское право
Методы обучения, воспитания
- Проблемные методы (вопросы).
- Словесно-наглядный (мультимедийная презентация).
- Частично-поисковый (выполнение заданий).
- Диалоговый метод (беседа, взаимообсуждение).
Оборудование занятия и технические средства
- Раздаточный материал по теме.
- Нормативные правовые акты (КоАП РФ).
- Тестовое задание.
- Презентация по теме учебного занятия.
- Ноутбук, проектор.
Методы контроля
- индивидуальный
- текущий
Формируемые компетенции:
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
ОК 9. Ориентироваться в условиях постоянного изменения правовой базы.
Ход занятия
|
№ п/п |
Структурные элементы занятия |
Содержание элемента занятия. Используемые методы и приемы |
Время, мин |
Методическое обеспечение |
|
1 |
Организационный момент |
Приветствие студентов Проверка присутствующих |
1 |
|
|
2 |
Постановка целей и задач |
Сообщение темы занятия и плана работы Конкретизация задач и создание мотивации учебной деятельности Прием – повествовательное изложение Форма – рассказ-вступление |
5 |
По плану занятия |
|
3 |
Систематизация ранее полученных знаний |
Работа с группой ответы на вопросы: 1.Что такое юридическая ответственность? 2. Какие виды юридической ответственности Вам известны? Метод – фронтальный опрос |
5 |
|
|
4 |
Изучение нового материала |
Объяснение нового материала. Рассматриваемые вопросы:
Метод – частично-поисковый, самостоятельная работа с НПА (КоАП РФ – заполнение таблицы по мерам административного наказания) Фронтальная работа по выполненному заданию Прием – повествовательное изложение |
20 |
Лекция, презентация, КоАП РФ, методические указания по выполнению заданий на занятии, критериальность оценки деятельности студентов на занятии |
|
5 |
Закрепление и систематизация полученных знаний |
Решение тестовых заданий Прием – частично-поисковый Форма – тестовый контроль первичного усвоения |
10 |
Рабочая тетрадь с конспектом лекции |
|
6 |
Подведение итогов занятия |
Анализ качества работы студентов индивидуально и всей группы в целом, оценка работы. Ориентация на следующее занятие. Прием – повествовательное изложение Форма – рассказ — заключение |
3 |
|
|
7 |
Домашнее задание |
Работа с конспектом лекции; заполнить таблицу «Меры административного наказания» |
1 |
Рабочая тетрадь |
- Организационный момент
Здравствуйте, садитесь. Кто отсутствует сегодня на занятии? (проверка отсутствующих по журналу)
2. Мотивация и целеполагание
На сегодняшнем занятии нам предстоит изучить новую тему, поэтому мы будем работать как индивидуально, так и в группах, используя при этом лекционный материал, а так же ранее полученные знания на других дисциплинах специального цикла.
В процессе оценивания результатов работы на занятии будут участвовать все: и я, и вы, оценивая друг друга, руководствуясь критериями, которые лежат у вас на столах в папке с дидактическими материалами. На каждом этапе работы вы будете обращаться к критериям самостоятельно.
При этом каждый из вас должен помнить о том, что для вашей специальности и дальнейшей профессиональной деятельности очень важны такие качества как добросовестность и профессиональная ответственность за результат своего труда. Данные качества вы сможете продемонстрировать уже на сегодняшнем занятии.
Поскольку на учебных дисциплинах: Трудовое право, Уголовное право, Гражданское право Вы уже в общем плане касались вопроса о юридической ответственности, то я попрошу вас вспомнить
Вопрос: Что такое юридическая ответственность?
Ответ: это применение мер государственного принуждения к виновному лицу за совершение противоправного деяния.
Вопрос: Какие виды юридической ответственности Вам известны?
Ответ: уголовная, материальная, гражданско-правовая, дисциплинарная.
Совершенно верно, но Вы не назвали еще один вид юридической ответственности, как раз, о котором сегодня пойдет речь на нашем учебном занятии. Это Административная ответственность….
Исходя из этого попробуйте сформулировать цель нашего сегодняшнего занятия.
Целью нашего сегодняшнего занятия является изучение административной ответственности, ее особенности и признаки.
Совершенно верно, исходя из цели задачи нашего урока следующие:
— проанализировать понятие и особенности административной ответственности;
— выявить правовые основы административной ответственности;
— изучить структурный состав административного правонарушения и его правовую характеристику;
— рассмотреть меры административного наказания.
Сегодняшняя наша работа будет состоять из нескольких этапов:
- Изучение нового материала по теме.
- Работа с КоАП РФ по заполнению таблицы.
- На этапе закрепления изученного на занятии материала, вам будет предложено выполнить тестовое задание.
Слайд 1: Итак, приступим к изучению нового материала, открываем рабочие тетради, записываем тему: Административная ответственность, правонарушение и меры наказания и вопросы, которые нам необходимо будет изучить:
СЛАЙД 2:
- Понятие и особенности административной ответственности
- Понятие, признаки, состав административного правонарушения
- Понятие и меры административного наказания
Слайд 3: Вопрос 1: Понятие и особенности административной ответственности
Итак, прежде чем мы перейдем к изучению особенностей административной ответственности, необходимо сформулировать определение административная ответственность.
Я предлагаю выполнить упражнение «Мозговой штурм». Прошу Вас назвать слова, выражения, ассоциирующиеся с термином административная ответственность. (Называют: юридическая ответственность, закон, меры наказания, правонарушение).
А теперь давайте соотнесем наши ассоциации с определением из КоАП РФ.
Слайд 4: Административная ответственность – это одна из видов юридической ответственности, применяемая широким кругом уполномоченных органов власти в качестве мер административного наказания на основании закона к лицу, совершившему административное правонарушение.
Слайд 5: Особенности административной ответственности:
- основанием административной ответственности является совершение
административного правонарушения;
Cлайд 6
- административная ответственность распространяется на всех (как на физические, так и на юридические лица); Имеются также специальные субъекты административной ответственности (военнослужащие, граждане, призванные на военные сборы, несут ответственность в соответствии с Дисциплинарным Уставом; сотрудники ОВД, Федеральных налоговых органов, таможенных органов, несут
административную ответственность в соответствии с НПА,
регламентирующими порядок прохождения службы в этих органах).
Слайд 7:
- за совершение административного правонарушения налагается
административное наказание, которое применяется широким кругом
уполномоченных органов власти, применение которого не влечет судимости. Лицо, к которому оно применено, считается имеющим административное наказание в течение определенного срока.
Слайд 8:
- меры административной ответственности применяются не только в соответствии с федеральным законодательством, а также в соответствии с
законами субъектов РФ (основным нормативным актом, регулирующим вопросы АО на федеральном уровне, является Кодекс РФ об административных правонарушениях, который был введен в действие с 1 июля 2002 года, Закон Омской области от 24 июля 2006 г. № 770-ОЗ «Кодекс Омской области об административных правонарушениях»);
Слайд 9:
- административная ответственность наступает независимо от того, наступили ли отрицательные последствия от данного правонарушения, достаточно самого факта нарушения правил (пример: переход улицы в
неположенном месте, неуплата налогов, штрафов).
Итак, что непонятно по данному материалу? Если вопросов нет, то переходим к изучению следующего вопроса:
Слайд 10: Понятие, признаки, состав административного правонарушения
Назовите выражения, ассоциирующиеся с термином правонарушение. (Называют: вина, противоправность, действие, бездействие, ответственность).
А теперь давайте соотнесем наши ассоциации с определением из КоАП РФ.
Слайд 11: Согласно ч. 1 ст. 2.1 КоАП РФ Административным правонарушением признается противоправное, виновное действие (бездействие) физического лица или юридического лица, за которое КоАП или законами субъектов РФ об административных правонарушениях установлена административная ответственность.
Слайд 12: Анализ данного понятия, позволяет выделить следующие признаки административного правонарушения.
Общественная опасность. В результате совершения административного правонарушения причиняется ущерб (урон) правам и законным интересам граждан, общества и государства.
Противоправность – т.е. закрепленность в нормативном акте в качестве адм. правонарушения.
Виновность – означает, что АП совершается осознанно, т.е. умышленно или по неосторожности.
Наказуемость – т.е. установление административного наказания за его совершение.
Рассмотренные признаки дают представление об общем понятии АП, они характерны для всех АП, вместе с тем, ответственность всегда конкретна и должна применяться за определенные деяния.
Кодекс же при установлении ответственности за его совершение выделил наиболее главные, существенные признаки.
(Например: нецензурную брань в общественных местах, оскорбительное приставание к гражданам, а равно уничтожение или повреждение чужого имущества, совокупность таких признаков и образует состав АП, позволяющий осуществлять квалификацию).
Поэтому правонарушение квалифицируется по составу.
Слайд 13: Итак, состав административного правонарушения – это установленная законом совокупность объективных и субъективных признаков, наличие которых повлечет ответственность.
Слайд 14: Элементами состава административного правонарушения являются: 1. объект административного правонарушения; 2. объективная сторона административного правонарушения; 3. субъект административного правонарушения; 4. субъективная сторона административного правонарушения.
В нашей группе присутствуют студенты, которые пропустили часть учебных занятий и отстают в освоении материала, заранее им было выдано задание и им предстоит сейчас выступить перед аудиторией. (два студента характеризуют состав правонарушения)
1студент Объектом административного правонарушения являются общественные отношения, интересы или блага, которым причиняется вред.
Общим объектом является порядок управления, родовой указан в названиях глав Особенной части 2 Раздела КоАП РФ, а непосредственным является объект конкретного АП.
Объективная сторона административного правонарушения – это его внешнее проявление. В нее входит:
- деяние, т.е. действие или бездействие. Большинство АП совершаются путем действия (например: распитие спиртных напитков в общественных местах, мелкое хищение или мелкое хулиганство).
Но отдельные правонарушения могут совершаться путем бездействия (например: проживание без регистрации, несоблюдение правил пожарной безопасности, уклонение от регистрации или перерегистрации огнестрельного оружия).
2. общественно вредные последствия. Большинство составов АП формальные, т.е. они окончены в момент одного лишь деяния (например: нарушение паспортных правил, правил воинского учета и т.п.) и не требуют наступления каких — либо последствий. Часть же из них материальные, т.е. требующие для признания их оконченными наступление определенных последствий (например: ст. 12.24 КоАП РФ Нарушение правил дорожного движения, повлекшее причинение легкого или средней тяжести вреда здоровью потерпевшего).
3. причинная связь между ними – это такая связь, при которой именно данное деяние является главной и непосредственной причиной наступления общественно — вредных последствий.
4. время, место, способ совершения деяния – если эти признаки включены в состав объективной стороны, это означает, что конкретное деяние запрещается не вообще, а лишь совершенное в определенном месте, в определенное время или определенным способом. Так для состава мелкого хулиганства необходима нецензурная брань именно в общественных местах. Административно — наказуемо также, появление в состоянии опьянения, оскорбляющем человеческое достоинство и общественную нравственность только в общественных местах.
2 студент: Субъектом административного правонарушения признается лицо, совершившее общественно опасное деяние и способное нести административную ответственность (обладающее административной деликтоспособностью), либо виновное юридическое лицо.
Административной ответственности подлежат, постигшие 16 лет на момент совершения административного правонарушения граждане России, должностные лица, иностранные граждане, не обладающие дипломатической неприкосновенностью, а так же лица, без гражданства.
Наряду с возрастом, в отношении физических лиц, должна устанавливаться их вменяемость. Согласно ст. 2.8 КоАП РФ, не подлежит административной ответственности лицо, которое во время совершения противоправных действий или бездействия находилось в состоянии невменяемости, т.е. неспособность лица осознавать фактический характер и общественную опасность своих действий либо руководить ими вследствие хронического психического расстройства, временного психического расстройства, слабоумия или иного болезненного состояния психики.
Субъективная сторона административного правонарушения это психическое отношения субъекта к совершенному им общественно опасному деянию и к наступившим последствиям, выраженное в форме умысла или неосторожности.
Административное правонарушение признается совершенным умышленно, если (лицо его совершившее сознавало противоправный характер своего действия (бездействия), предвидело наступление его вредных последствий, желало или сознательно их допускало, либо относилось к ним безразлично). Об умысле свидетельствует характер правонарушения (например: обман потребителей (ст. 14.7 КоАП РФ), неповиновение законному требованию сотрудника полиции (ст. 19.3), мелкое хулиганство (ст. 20.1).
Административное правонарушение признается совершенным по неосторожности если лицо его совершившее предвидело возможность наступления вредных последствий своего действия (бездействия), но без достаточных к тому оснований самонадеянно рассчитывало на предотвращение таких последствий либо не предвидело возможности наступления таких последствий, хотя должно было и могло их предвидеть. (Например, передавая управление транспортным средством лицу, не имеющему право управления им, водитель рассчитывает, что при малой интенсивности движения и его опыте, он сможет предотвратить возникновение аварийной обстановки, но этого не происходит).
Сделаем выводы:
Вопрос 1: Что является объектом правонарушения?
Ответ: Объектом административного правонарушения являются общественные отношения, интересы или блага, которым причиняется вред, т.е. то на что направлено противоправное действие.
Вопрос 2: Что такое объективная сторона?
Ответ: Объективная сторона административного правонарушения – характеристика самого деяния (время, место, способ совершения).
Вопрос 3: Субъект правонарушения?
Ответ: Субъектом административного правонарушения является лицо, совершившее противоправное деяние.
Вопрос 4: Что такое субъективная сторона?
Ответ: Субъективная сторона административного правонарушения это психическое отношения субъекта к совершаемому деянию, выражается в форме умысла или неосторожности.
Хорошо, молодцы! Если вам все понятно, переходим к изучению следующего вопроса.
Слайд 15: Понятие и меры административного наказания.
Попробуйте назвать выражения, ассоциирующиеся с термином наказание. (Называют: ответственность, государство, закон, правонарушение, правонарушитель).
А теперь давайте соотнесем наши ассоциации с определением из КоАП РФ.
Слайд 16: Итак, административное наказание – это установленная государством мера ответственности за совершение административного правонарушения, применяемая в целях предупреждения совершения новых правонарушений как самим правонарушителем, так и другими лицами.
В соответствии с КоАП РФ административные наказания делятся на два вида: основные и дополнительные.
Задание следующее: Не заглядывая в КоАП РФ попробуйте самостоятельно распределить меры наказания по видам и записать их в соответствующий столбик.
Выполняют самостоятельно. Давайте проверим, что у вас получилось. Слад 17: Основные меры
Слайд 18: Дополнительные меры.
|
Основные меры |
Дополнительные меры |
|
— предупреждение — административный штраф — лишение специального права, предоставленного физическому лицу, за исключением права управления транспортным средством — административный арест — дисквалификация — административное приостановление деятельности -обязательные работы |
— конфискация орудия совершения или предмета административного правонарушения — лишение специального права в виде права управления транспортным средством — административное выдворение за пределы Российской Федерации иностранного гражданина или лица без гражданства — административный запрет на посещение мест проведения официальных спортивных соревнований в дни их проведения. |
Вопрос: Итак, для того, чтобы охарактеризовать меры административного наказания, к какому НПА нам необходимо обратиться?
Ответ: КоАП РФ
Из ТГиП Вы знаете, что работа с нормативно – правовыми актами очень важна, т.к. она способствует получению точных и прочных знаний по изучаемому вопросу, что позволяет создать наиболее полное представление о мерах административного наказания.
Полученные в ходе изучения нормативно – правовых актов знания и умения создадут основу для вашего дальнейшего обучения в области права.
Для совершенствования навыков работы с КоАП РФ на данном этапе работы необходимо будет каждому выполнить следующее задание.
СЛАЙД 19, 20: Задание: 1 вариант характеризуют Основные меры АН, а 2 вариант – дополнительные меры АН, путем заполнения таблицы, используя КоАП РФ.
Перед тем, как выполнить задание, обратимся к дидактическим материалам, разработанным мной для вас, и содержащим «Критерии оценки вашей деятельности».
Для студентов, у которых возникнут затруднения при работе с нормативным актом, я разработала памятку «Алгоритм работы с НПА», можете её использовать. (Работают с КоАП РФ)
|
Мера наказания |
Размер/Срок |
Субъекты (физ/юр. л.) |
Желающие ответить по таблице. СЛАЙД 21-30
Молодцы, вы верно заполнили таблицу.
Для того, чтобы убедиться, что тема сегодняшнего занятия вам всем понятна и усвоена, вам необходимо выполнить тестовое задание, а затем поменяться решенными вариантами и оценить друг друга.
Напоминаю, что критерии оценки данного этапа имеются в дидактических материалах, у вас на столах. Правильные же ответы будут представлены на слайде 31 после выполнения задания.
На сегодняшнем занятии мы изучили тему: «АО,АП,меры АН», изученный материал нам понадобиться на следующее практическое занятие, где мы будем заполнять правоприменительный акт (Протокол об административном правонарушении).
А сейчас я предлагаю вам поделиться своим мнением по поводу того, что нового вы узнали сегодня на занятии, возможно, что хотели узнать, но не узнали? (Отвечают студенты по желанию.)
Контроль первичного усвоения материала показал, что большинством из Вас (Всеми) тема усвоена, результатом успешной работы на занятии являются те оценки, которые Вы сегодня получили, как работая самостоятельно, так и по вариантам.
Активно сегодня на занятии работали следующие студенты:
— отвечали на вопросы на протяжении всего занятия….
— работа с КоАП РФ по заполнению таблицы….
— решение тестового задания.
Прошу записать д/з: выучить все определения по теме, и дописать таблицу по мерам административного наказания. Считаю, что цель нашего сегодняшнего занятия достигнута. Спасибо. Урок окончен. До свидания.
Приложения:
- file1.zip.. 10,9 МБ



 Цель
Цель