Сведения об авторе
Фамилия, имя, отчество (полностью)
Цыбасова Татьяна Викторовна
Район
Советский район г.Нижнего Новгорода
Место работы
Муниципальное автономное образовательное учреждение средняя школа №151 с углубленным изучением отдельных предметов
Должность
Учитель химии
Общая информация
Образовательная область, учебный предмет
Химия
Класс
9
Авторская программа к учебникам (линии учебников или УМК) (если есть)
Авторская программа по химии (базовый уровень) 9 класс. Автор Габриелян О.С.
Тема учебного занятия
Тема урока или другой формы организации УВП: экскурсия, консультация, проект, лабораторное занятие, практикум, игра и т.п.
Тема урока: «Галогены. Общая характеристика»
Место урока или другой формы организации учебной деятельности в структуре учебного занятия
Тема «Неметаллы» (23 часа)
Урок 1. Общая характеристика неметаллов
Урок 2. Неметаллы: атомы и простые вещества, аллотропия
Урок 3. Химические элементы в клетках живых организмов
Урок 4. Водород
Урок 5. Галогены. Общая характеристика
Урок 6. Соединения галогенов
Урок 7. Получение галогенов и их значение
Урок 8. Кислород
Учебная задача
Познакомить учащихся с химическими элементами – галогенами, их строением атома, характеристиками и свойствами; с простыми веществами-галогенами, их характеристиками и свойствами
Вовлечь учащихся в проблемную ситуацию: найти закономерность физических и химических свойств простых веществ от положения химического элемента в Периодической системе химических элементов
Обобщенные цели учебного занятия — планируемые результаты
Цель
Уровень
Базовый («обучающийся научится»)
Цель – предмет (предметный результат)
Обучающиеся научатся составлять схемы строения атомов химических элементов-галогенов, узнают о физических и химических свойствах простых веществ-галогенов, нау-чатся писать уравнения реакций взаимодействия галогенов с металлами, неметаллами, с солями
Цель – способ (метапредметный результат)
Обучающиеся овладеют умениями: работать с информацией презентации и учебника, приме-нять полученную информацию при составлении уравнений; находить закономерности свойств простых веществ, коллективно выбирать оптимальный способ деятельности, при-менять эту информацию на практическом опыте, организовывать собственную познава-тельную и практическую деятельность, работать в парах, анализировать и оценивать по-лученный результат своей деятельности; применять знания о закономерностях свойств в новой ситуации
Цель – ценность (личностный результат)
Обучающиеся узнают о роли химических элементов-галогенов для своего здоровья, о необходимости соблюдать правила техники безопасности при работе с ядовитыми простыми веществами-галогенами.
-имеют опыт работы с различными источниками информации, участия в обсуждении;
— знают правила техники безопасности;
-знают, о строении атомов химических элементов, могут составлять схемы строения атома, зная положение химического элемента в Периодической системе;
-могут записывать уравнения реакций между металлами и неметаллами;
-способны выбирать нужную информацию из различных источников и в кратком виде представлять ее в виде сообщения;
-могут сопоставлять информацию, аргументировать, выбирать оптимальный вариант для осуществления практической деятельности;
-могут планировать свою умственную и практическую деятельность;
-могут осуществлять самоконтроль различных видов деятельности;
Исходное состояние обучающихся:
-имеют опыт работы с различными источниками информации, участия в обсуждении;
— знают правила техники безопасности;
-знают, о строении атомов химических элементов, могут составлять схемы строения атома, зная положение химического элемента в Периодической системе;
-могут записывать уравнения реакций между металлами и неметаллами;
-способны выбирать нужную информацию из различных источников и в кратком виде представлять ее в виде сообщения;
-могут сопоставлять информацию, аргументировать, выбирать оптимальный вариант для осуществления практической деятельности;
-могут планировать свою умственную и практическую деятельность;
-могут осуществлять самоконтроль различных видов деятельности;
-имеют опыт работы с различными источниками информации, участия в обсуждении;
— знают правила техники безопасности;
-знают, о строении атомов химических элементов, могут составлять схемы строения атома, зная положение химического элемента в Периодической системе;
-могут записывать уравнения реакций между металлами и неметаллами;
-способны выбирать нужную информацию из различных источников и в кратком виде представлять ее в виде сообщения;
-могут сопоставлять информацию, аргументировать, выбирать оптимальный вариант для осуществления практической деятельности;
-могут планировать свою умственную и практическую деятельность;
-могут осуществлять самоконтроль различных видов деятельности
;
Формы оценки планируемых результатов
Предметный результат
Метапредметный результат
Личностный результат
Составление конспекта в тетради
Фронтальная работа в эври-стической беседе.
Выполнение теста по изу-ченной теме
Участие в обсуждении, нахожде-ние оптимального способа прак-тической деятельности.
Работа в парах, ответы на по-ставленные учителем вопросы
Понимание связи между здоровьем человека и на-личием химических эле-ментов в клетке. Понима-ние необходимости знаний о свойствах веществ
Комментарии учителя к учебному занятию или уроку
На предыдущем уроке учащиеся учились писать уравнения взаимодействия водорода с ме-таллами и галогенами
Учебно – информационное и техническое обеспечение учебного занятия
Учебно – информационное обеспечение
Основная лите-ратура
Дополнительная литература
Интернет-ресурсы
ЭОРы
Габриелян О.С.Химия. 9 класс- М.: Дрофа, 2014
Габриелян О.С., Остроумов И.Г.Настольная книга учителя. Химия. 9 класс. М.:Дрофа, 2002
Презентация на сайте https://nsportal.ru/tybasova-tatyana
https://nabi-ildar.ru/hlor/
https://www.liveinternet.ru/users/4845230/post240839471/
Техническое обеспечение
Мультимедийный проектор, персональный компьютер
Дидактическая структура учебного занятия (урока) и его психолого – педагогическое обоснование
Этап урока
Подэтап урока
Организация педагогически целесообразного взаимодействия
Психолого – педагогическое обоснование
1.Мотивационно- ориентировочный
1.1. Вхождение в контакт
- Подготовка учащихся к учебной деятельности. Фасилитационный подход.
- По источнику передачи и восприятию учебной информации: словесные (беседа)
Создание комфортной психологической атмосферы урока, настраивание на рабочий ритм
1.2. Актуализация субъектного опыта обучающихся и проверка домашнего задания
- По источнику передачи и восприятию учебной информации: словесные (беседа)
- По характеру управления учебной работой: самостоятельная работа.
- Включение каждого в конкретную деятельность на уже освоенном материале
Опора на уже имеющиеся знания и умения обучающихся, полученные на предыдущем уроке, их проверка
2. Операционно – исполнительский
2.1. Целеполагание и планирование
• Формулирование цели урока как прогностической модели ожидаемого результата
• Построение ориентировочной основы учебной деятельности (план урока):
1. Организационный этап – 2 мин.
2. Актуализация знаний и проверка дом.задания – 1 мин.
3. Целеполагание – 1 мин.
4. Введение новых знаний – 26 мин
5. Первичное обобщение, введение новых знаний в систему знаний учащихся – 2 мин
6. Закрепление нового материала -10 мин.
7. Подведение итогов, рефлексия -2 мин.
8. Определение домашнего задания и инструктаж по его выполнению – 1 мин.
Реализация субъект-субъектных отношений, участие обучающихся в постановке дидактической цели урока
2.2. Введение новых знаний
По источнику передачи и восприятию учебной информации: словесные (беседа, рассказ).
По степени самостоятельности мышления обучающихся: репродуктивные (объяснительно-иллюстративные – работа с презентацией, бесе да) и продуктивные (частично-поисковый –проблемная задача, беседа)
Происходит активная познавательная деятельность.
2.3. . Первичное обобщение и введение новых знаний в систему знаний учащихся
По источнику передачи и восприятию учебной информации: словесные (беседа), практические (упражнения)
По степени самостоятельности мышления обучающихся: репродуктивные
Учащиеся анализируют полученные знания, оценивают их качество, уточняют спорные моменты, применяют свои знания на простейших примерах.
2.4 Закрепление нового материала
Проблемный метод.
По степени самостоятельности мышления обучающихся: репродуктивные
Развиваются исследовательские компетенции учащихся: работа с различными источниками информации и ИКТ, подборка методов для решения конкретной задачи, составление плана работы, умение взаимодействовать, дискутировать, эффективно работать в парах.
3. Рефлексивно – оценочный
3.1. Подведение итогов, рефлексия
Выявление уровня осознания каждым обучающимся степени освоенности содержания (знаю что?), владения действиями (знаю как?), понимания смысла изученного (знаю зачем?) и понимания степени своих личностных приращений (знаю, что во мне изменилось?)
Учащиеся еще раз анализируют свою работу на уроке, оценивают ее (самооценка результатов деятельности)
3.2. Определение домашнего задания и инструктаж по его выполнению
Объяснение домашнего задания и требований к его выполнению
Осмысление процесса решения учебной задачи, ее предметных оснований, а также своих способностей к осуществлению данного рода учебных действий, усвоения их принципов построения
Сценарий проведения учебного занятия
Этап урока или другой формы УВП
Подэтап урока или другой формы УВП
Действия учителя (педагога)
Действия обучающихся
(примерные версии ответов)
1.Мотивационно-ориентиовочный
1.1. Вхождение в контакт
Взаимное приветствие учителя и учащихся, фиксация отсутствующих, проверка готовности учащихся к уроку
Учащиеся настраиваются на работу
1.2. Актуализация субъектного опыта обучающихся и проверка домашнего задания
Какую тему мы изучали на прошлом уроке?
Что значит «неметаллические свойства химических элементов»? Какие особенности в строении атомов неметаллов вам известны?
Вспоминают изученный материал. Отвечают на вопросы учителя
Готовятся к активной учебно-познавательной деятельности
2. Операционно – исполнительский
2.1. Целеполагание и планирование
Демонстрирует простые вещества — галогены (хлор в колбе, бром в ампуле, кристаллики йода в колбе). Эти вещества образованы химическими элементами, называемыми «галогены», то есть рождающие соли. Почему их так назвали? Сегодня мы приступаем к изучению этих элементов
Совместно с учителем формулируют тему, планируя этапы ее изучения: строение атомов, химическая связь в простых веществах, физические и химические свойства простых веществ
2.2. Введение новых знаний
Найдите в Периодической системе химические элементы, расположенные в VII-А группе. Выпишите их химические символы и названия в тетрадь. Что общего в строении атомов этих химических элементов? В чем различия? Как изменяются неметаллические свойства, электроотрицательность, радиус атомов галогенов
Организует работу учащихся с презентацией при изучении свойств простых веществ — галогенов
Составляют в тетради конспект, на доске работают несколько человек, в парах отвечают на вопрос учителя, обсуждение
Пользуясь материалом слайдов презентации, выполняют задания в тетради.
2.3. Первичное обобщение и введение новых знаний в систему знаний учащихся
Беседа с учащимися с целью выявления трудностей, выяснение сложных моментов и их разбор.
Уравнения реакций, отражающие химические свойства галогенов, записываются на доске
2.4. Закрепление нового материала
Объясняет задание по выполнению цепочки превращений.
Знакомит с биологической ролью галогенов, с интересными фактами использования галогенов и нахождения галогенов в природе
Выполняют задание в тетради и на доске, знакомятся с интересными сведениями о галогенах, задают вопросы
3. Рефлексивно – оценочный
3.1. Подведение итогов, рефлексия
Итак, подумайте, что нового вы узнали сегодня и чему научились. Почему галогены так называются? Нравятся ли вам ваши результаты?
Осознают полученные образовательные результаты, дают отзыв по итогам урока, рефлексируют.
3.2. . Определение домашнего задания и инструктаж по его выполнению
Домашнее задание: выучить материал конспекта, выполнить цепочку превращений
Подведение итогов урока
Конспект открытого урока (мастер-класса) по теме:
«Общая характеристика галогенов». 9 класс.
Подготовила учитель химии МБОУ СОШ №4 г. Ставрополя Сергеева И.Д.
Раздел: Преподавание
|
Педагогическая цель |
Обучения — сформировать умение составлять сравнительную характеристику галогенов как свободных атомов и простых веществ (строение атомов, физические и химические свойства). Повторить, обобщить, закрепить и конкретизировать на материале химии галогенов важнейшие химические понятия. Воспитания— способствовать формированию научно-материалистического мировоззрения, причинности познаваемости явлений, взаимообусловленности в природе; сформировать убеждение в том, что опыт- это инструмент познания, что мир познаваем, учить анализировать ответы товарищей, понимать свои ошибки. Развития— формирование культуры общения при работе в парах, трудолюбия, формирование отношения к познанию как к социально-культурной ценности человечества. |
|
Тип, вид урока |
Урок постановки учебной задачи, комбинированный |
|
Планируемые результаты (предметные) |
Умения составлять характеристику галогенов по их положению в Периодической системе химических элементов Д. И. Менделеева; характеризовать состав, строение молекул галогенов, физические и химические свойства галогенов; устанавливать причинно-следственные связи между строением атома, химической связью, типом кристаллической решетки галогенов, их физическими и химическими свойствами; составлять уравнения реакций, характеризующих химические свойства галогенов — простых веществ; наблюдать и описывать реакции с участием галогенов с помощью естественного (русского или родного) языка и языка химии |
|
Личностные результаты |
Понимание значимости естественнонаучных знаний в повседневной жизни, технике, медицине, для решения практических задач. Умение грамотно обращаться с веществами в химической лаборатории и в быту |
|
Универсальные учебные действия (метапредметные) |
Умения использовать знаково- символические средства для раскрытия сущности процессов; осуществлять сравнение и классификацию, устанавливать причинно- следственные связи; проводить наблюдения, делать выводы |
|
Формы и методы обучения |
Групповая (просмотр презентации, работа с текстом), парная работа, индивидуальная (беседа, работа с тестом), проблемное обучение (решение проблемных вопросов). Метод самостоятельной работы с последующей само- или взаимопроверкой и коррекцией допущенных ошибок |
|
Понятия и термины |
Строение атомов галогенов; физические свойства галогенов; химические свойства галогенов. |
|
Демонстрации. Лабораторные опыты. |
Демонстрации. Образцы галогенов — простых веществ. ЦОРВзаимодействие галогенов с натрием, с алюминием. Вытеснение хлором брома или иода из растворов их солей |
|
Оборудование |
Компьютер, проектор, презентация «Общая характеристика галогенов», интерактивная доска, ПСХЭ Д.И. Менделеева, таблица «Галогены», карточки с заданиями. |
|
Вид используемых на уроках средств ИКТ |
Универсальные (электронные книги, компьютер, интерактивная доска) |
|
Образовательные ресурсы |
*http://school-collection.edu.ru – Единая коллекция цифровых образовательных ресурсов (далее выбрать раздел). |
Ход урока.
1.Организационная структура урока.
ЭТАП 1. Проверка остаточных знаний. Осознание приращения знания (ликвидация незнания)
Проверка домашнего задания./7-12 мин/
ЭТАП 2. Вхождение в тему урока и создание условий для осознанного восприятия нового материала
Диалог на уроке. Демонстрационный химический эксперимент /10-15 мин/.
ЭТАП 3. Организация и самоорганизация обучающихся в ходе дальнейшего усвоения материала
Обобщение и систематизация пройденного материала. /10-15 мин/.
ЭТАП 4. Подведение итогов, домашнее задание /3-5 мин/.
Ход урока.
I. Проверка домашнего задания
2. Устные вопросы у доски:
Вопросы и задания.
1) Охарактеризуйте строение атомов водорода, его изотопов. Объясните причину двойственного
положения водорода в Периодической системе Д. И. Менделеева.
2) Послушайте сообщение о применении тяжелых изотопов водорода (индивидуальная пре-
зентация обучающегося).
3) Охарактеризуйте физические свойства простого вещества — водорода и способы его получения
в лаборатории и в промышленности.
4) Дайте характеристику химических свойств водорода.
5) Преобразуйте схему в уравнения реакций с участием водорода и его соединений:
H2→ HCl → H2→ H2O → KOH → H2
↑
KH
II. Диалог на уроке. Демонстрационный химический эксперимент
1)Формирование умений характеризовать строение атомов галогенов по их положению в Периодической системе Д. И. Менделеева;
2)характеризовать строение молекул галогенов; составлять сравнительную характеристику физических и химических свойств галогенов.
3)Актуализация знаний обучающихся об окислительно-восстановительных реакциях.
Изучение нового материала происходит с опорой на содержание § 20 учебника.
III. Изучение нового материала.
План изучения нового материала:
1. Положение галогенов в Периодической системе Д.И. Менделеева и строение их атомов.
2. Галогены – простые вещества и их свойства.
1. Положение галогенов в Периодической системе Д.И. Менделеева и строение их атомов.
Вопросы и задания:
1) Какое положение занимают галогены в периодической таблице Д. И. Менделеева?
2) Сколько электронов содержат атомы галогенов на внешнем энергетическом уровне? Какие свойства проявляют галогены? (7 электронов, типичные неметаллы)
-Какие значения высшей и низшей степени окисления проявляют галогены в соединениях? Может
ли фтор проявлять в соединениях положительную степень окисления? Обоснуйте ответ.
— Как в подгруппе галогенов изменяются металлические свойства? (Возрастают сверху вниз.
В пределах каждого периода галогены обладают наибольшей электроотрицательностью).
2. Галогены – простые вещества и их свойства.
Проблемный вопрос урока. Какими особыми физическими и химическими свойствами
обладают галогены? Чем обусловлены сильные окислительные свойства галогенов — простых
веществ? (слайд)
1) Какой тип химической связи существует в молекулах галогенов? (ковалентная неполярная химическая связь).
2) Какой тип кристаллической решетки свойственен галогенам? (молекулярная кристаллическая решетка).
3) Какими физическими свойствами должны обладать галогены — простые вещества?
Демонстрации. Образцы галогенов — простых веществ.
Запись в тетради:
Галогены: VII группа, главная подгруппа -F, Cl, Br, I, At. (слайд)
Строение внешнего энергетического уровня атомов галогенов: nS2 nP5 (слайд)
Высшая степень окисления в соединениях +7 (кроме фтора), низшая степень окисления–1.
Г2 — простые вещества — галогены, промежуточные значения: 0, +1 , +3, +5
Физические свойства галогенов: (слайд)
F2 фтор, светло-желтый газ с резким раздражающим запахом.
Cl2 хлор, желто-зеленый газ с резким удушливым запахом.
Br2 бром красно-бурая жидкость с резким зловонным запахом.
I2 иод- серо-черные кристаллы (пары́ — фиолетовые) с резким запахом.
Сверху вниз по группе Увеличение температуры кипения, температуры плавления, интенсивности окраски простых веществ — галогенов.
Демонстрация лабораторного опыта №3 «Растворимость иода в органических растворителях»- коллекция ЕК ЦОР по теме.
4) Как в названиях галогенов отражаются их свойства? (Название галогены переводится как «рождающие соли»).
Запись в тетради.
Химические свойства галогенов: (слайд)
Галогены – сильнейшие окислители. Химическая активность галогенов уменьшается в ряду:
F2 Cl2 Br2 I2.
Галогены взаимодействуют практически со всеми простыми веществами, наиболее энергично реакция протекает с металлами.
Взаимодействие галогенов с металлами с образованием солей-галогенидов («солерождающие»-групповое название) (слайд)
Выполнение заданий сопровождается последующей само- или взаимопроверкой и, в случае необходимости, коррекцией допущенных ошибок.
|
Zn + F2 = ZnF2 2Na + Cl2 = 2NaCl t 2Fe + Cl2 = 2FeCl3 2Na + I2 = 2NaI. |
Cu + Br2 = CuBr2 Fe + I2 = FeI2 2Al + 3I2 = 2All3 |
5) Как будет изменяться скорость взаимодействия галогенов с водородом от фтора к иоду?
Аргументируйте свою точку зрения.
Взаимодействие галогенов с водородом (слайд)
Н2 + F2 = 2HF – со взрывом
H2 + Cl2 = 2HCl – при облучение со взрывом
Н2 +Br2 = 2HBr – при нагревании без взрыва
Н2 + I2 = 2HI – медленно при нагревании без взрыва
Скорость реакции уменьшается.
С кислородом взаимодействует только фтор: F2 + О2 = О2 F2 (слайд)
Остальные галогены с кислородом непосредственно не взаимодействует.
Хлор и бром с углеродом, азотом, кислородом не реагируют. С другими неметаллами реагируют:
2P +3 Cl2 = 2PCl3
6) Как должна изменяться химическая активность галогенов — простых веществ от хлора к иоду?
Запись в тетради.
Bытеснение галогенами друг друга из растворов солей(слайд):
Ряд активности галогенов F2 Cl2 Br2 I2 Так, хлор вытесняет бром и йод (но не фтор), бром в состоянии вытеснить только йод из растворов соответствующих солей. (cлайд )
Правило: Более активный галоген вытесняет менее активный. Иод не вытесняет галогены из их солей.
Лабораторный опыт№4: «Вытеснение одних галогенов другими из соединений (галогенидов)- коллекция ЕК ЦОР по теме.
Cl2 + 2NaBr = 2naCl + Br2
Br2 + 2NaI = 2 NaBr + I2
Взаимодействие галогенов с водой (слайд)
Фтор не вытесняет галогены из растворов солей, т.к. взаимодействует с водой, вытесняя из нее кислород:
2F2 + 2 H2O = 4HF + O2
Хлор взаимодействует с водой с образованием двух кислот:
Cl2 + H2O = HClO + HCl.
7) Может ли иод вытеснить хлор из раствора хлорида натрия? Аргументируйте свой ответ.
Запись в тетради.

обучающегося).
III. Домашнее задание: Учитель дает комментарий к домашнему заданию.
§ 20; выполнить задания № 6 и 7
IV. Первичное закрепление учебного материала. Обобщение и систематизация пройденного материала.
Вопросы:
1)Где расположены галогены в ПСХЭ?
2)Какое количество внешних электронов содержится в оболочке атомов этих элементов?
3)какие степени окисления могут проявлять элементы галогены в соединениях?
4)как изменяется радиус в подгруппе?
5)Как изменяются окислительно-восстановительные свойства элементов в подгруппе?
6) Что означает термин «галоген»?
7) В виде каких молекул существуют галогены в свободном состоянии?
8)В каком агрегатном состоянии существуют простые вещества –галогены?
Учащиеся устно отвечают на проблемный вопрос урока. Какими особыми физическими и химическими свойствами обладают галогены? Чем обусловлены сильные окислительные свойства галогенов — простых веществ?
V. Рефлексия.
Учитель: Акцентирует внимание обучающихся на конечных результатах учебной деятельности на уроке.
-Узнали ли вы сегодня на уроке то, что вызвало у вас затруднение при работе с таблицей?
-Что нового вы узнали на уроке?
-Какие затруднения у вас возникли при работе на уроке?
-Что осталось непонятным при выполнении работы?
V1. Подведение итогов.
Акцентирует внимание на конечных результатах учебной деятельности учащихся на уроке
Оценивает работу обучающихся во время урока, комментирует оценки. Отмечает степень вовлеченности обучающихся в работу на уроке.
Учитель: Внимательно просмотрите свои записи в тетради. Все ли Вы успели сделать на уроке?
Если нет, тогда обратитесь за разъяснениями к учителю или к своим одноклассникам.
Урок окончен. Спасибо за урок всем. До свидания. (Слайд)
Открытый урок по химии в 9 классе на тему:
«Общая характеристика галогенов»
Цель урока: На основе положения галогенов в периодической системе элементов рассмотреть и сформировать знания о строении атомов галогенов, свойствах галогенах и их соединений, их применении
Задачи урока:
Образовательные: сформировать знания учащихся по теме «Неметаллы», дать понятие о галогенах их положении в ПСХЭ, строении атомов, свойствах, значении и применении. Развивающие: развитие познавательного интереса учащегося к предмету химия, формирование умения прослеживать причинно-следственные связи, развивать умения извлекать знания из различных источников, развивать умения обобщать и делать выводы6выделять главное, умения преодолевать трудности в учении, развитие навыков самоконтроля.
Воспитательные: воспитание ответственного отношения к учебе, воспитание решительности и смелости при выполнении заданий. Самостоятельности
Планируемые результаты:
1. Предметные:
— находить черты, свидетельствующие об общих признаках химических процессов и их различиях.
– объяснять значение веществ в жизни и хозяйстве человека.
— определять основные классы неорганических веществ;
— понимать смысл химических терминов.
2. Личностные:
— умение формировать высказывания, суждения, делать предложения;
— развитие умственной деятельности: умений обобщать, делать выводы.
3. Метапредметные:
— умение анализировать информацию, делать выводы на основании своих наблюдений;
— формирование устной речи: формулирование вопроса и ответа на вопрос;
— перенесение информации с учебной и справочной литературы в опорную схему;
— владение способами самоконтроля и самооценки;
— умение работать в группе.
Тип урока: комбинированный.
Методы: обьяснительно — иллюстративный, частично — поисковый.
Оборудование: компьютер, мультимедийный проектор, электронная презентация, дидактический материал
1 этап. Организационный момент – 1 мин
Учитель: Доброе утро. Садитесь. Готовьтесь к уроку (наличие учебных принадлежностей).
Работа с дежурным класса (отсутствующие).
2 этап. Актуализация знаний(4-5мин)
Учитель: Ребята, сегодня на уроке мы с вами продолжим знакомство с химическими элементами. Отгадывая загадки, вы определите тему нашего урока.
Фтор:
Я — светло-желтый газ
Во мне горит вода.
Всех, кто стоит мне на пути
Окислю я всегда.
Хлор:
Меня применяли даже в войну,
Я резкий, удушливый газ.
Мой запах и желто-зеленый цвет
Очень опасен для вас!
Бром:
В парах моих сгорает медь
Я бурый, прямо как медведь.
Открыт давно я был Баларом
И «бромосом» меня назвал он.
Йод:
Единственный похож я на металл,
Хотя металлом вовсе не являюсь.
В пробирку положите мой кристалл,
При нагревании легко я возгоняюсь.
Астат:
Я –самый редкий на Земле,
Ну что сказать вам обо мне,
Меня всего 16/100 (шестнадцать сотых) грамм,
За это в книгу Гинесса попал.
Учитель: Вы правильно угадали все химические элементы. Их называют галогены. Галогены герои нашего урока. Запишите в тетради тему урока «Общая характеристика галогенов».
3 этап. Изучение нового материала — 25 мин
Учитель: Элементы периодической системы – фтор, хлор, бром, йод и астат типичные неметаллы – называют галогенами — что в переводе с греческого означает «рождающие соли». Действительно, при взаимодействии галогенов с металлами возникает ионная химическая связь и образуются соли (вспомним из курса 8 класса образование ионной связи, с образованием соли).
План нашего урока:
-
Положение в ПСХЭ
-
Физические свойства
-
История открытия галогенов
-
Галогены в природе.
-
Химические свойства
-
Применение
-
Биологическая роль
-
Получение
-
Заключение
Слайд № 2
Учитель: Мы сейчас рассмотрим положение галогенов в ПСХЭ Менделеева и строение атома.
Перед вами Задание 1. (зашифрованное письмо) В 7-этажном доме на улице имени Д.И. Менделеева в 7 подъезде жили химические элементы – галогены. Расселились они по этажам, соблюдая строгую субординацию и в зависимости от своего богатства и прихотей. Те, которые очень любят полетать – повыше, которым это удается с трудом, расположились на нижних этажах. Но вместе их объединила очень важная особенность.
Задание: Обсудите информацию, зашифрованную в этом тексте. Перескажите этот текст, используя химические термины и понятия. Дайте характеристику по положению в ПСХЭ.
Учащиеся: Галогены расположены в периодической системе Д.И.Менделеева в 7 группе главной подгруппе. Окислительные свойства галогенов возрастают в ряду от астата к фтору. Фтор самый сильный окислитель, астат самый слабый окислитель. Общее у них на внешнем энергетическом уровне по 7 электронов – они все могут проявлять степень окисления -1, т. е принимать один электрон.
Учитель: Давайте рассмотрим строения атома фтора, хлора, брома.
(работают с ПСХЭ, в тетради записывают строение атомов галогенов. У доски один ученик выполняет задание)
Учитель: Фтор проявляет только окислительные свойства, остальные галогены проявляют и восстановительные свойства при взаимодействии с более электроотрицательными элементами – фтором, кислородом, азотом. Поэтому их с. о. могут принимать значения +1,+3,+5,+7. Восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с увеличением радиусов их атомов: атомы хлора примерно в полтора раза меньше, чем йода.
Слайд № 3
Физкультминутка
Учитель: Перед вами Задание 2. Физические свойства (работа с учебником).
Галогены не любят показывать свое лицо, обычно они прячутся за спинами других. Иногда, в экстремальных обстоятельствах, они появляются на свет и тогда все любуются их красивыми нарядами, но при этом страдают от крайне неприятного запаха.
Задание: Обсудите информацию, зашифрованную в этом тексте. Перескажите этот текст, используя химические термины и понятия.
Учащиеся: В этом задании речь идет о физических свойствах галогенов.
Учитель: Все верно, давайте рассмотрим физические свойства галогенов у доски и используя таблицу №7 на стр. 105 учебника.
(Один ученик работает у доски, ему помогает класс)
Учащиеся формулируют вывод: с увеличением молекулярной массы галогена повышается их температура плавления и кипения, возрастает плотность фтор и хлор – газы, бром-жидкость, йод — твердое вещество. Это связано с тем, что с увеличением размеров атомов и молекул галогенов возрастают и силы межмолекулярного взаимодействия между ними.
Слайды № 4
История открытия (сообщение ученика)
|
Фтор |
1866 г. |
“Фторос” — разрушающий. Анри Муассан был удостоен Нобелевской премии за открытие фтора. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз его был закрыт черной повязкой. В истории фтора немало трагических страниц. |
|
Хлор |
1774 г. |
“Хлорос” — желто-зеленый, открыл Шееле |
|
Иод |
1811 г. |
“Иодэс” — фиолетовый, открыл Куртуа. Любимый кот ученого прыгнул на бутылки, содержащие золу морских водорослей в спиртовом растворе и концентрированную серную кислоту. Бутылки разбились, жидкости смешались, с пола стали подниматься клубы сине-фиолетового пара, который и оказался иодом. |
|
Бром |
1826 г. |
“Бромос” — зловонный, открыл Балар. Получен при исследовании жидкости из растворенной в воде золы морских водорослей (при пропускании через нее хлора). |
Слайды № 5- 9
Учитель: Ребята, могут галогены в природе встречаться в свободном виде?
Учащиеся: Нет, т.к. у них ярко выражены окислительные свойства, химически очень активны.
Галогены в природе. Слайды №10-11
Учитель: Химическая активность галогенов от фтора к йоду ослабевает.
Переходим к химическим свойствам, более подробно рассмотрим свойства фтора и хлора.
Каждый галоген является самым сильным окислителем в своем периоде, Окислительные свойства отчетливо проявляются при взаимодействии с металлами, при этом, как вы уже знаете, образуются соли. Так, фтор при обычных условиях реагирует с большинством металлов, при нагревании и с золотом, серебром, платиной, известными своей химической пассивностью.
Уравнения реакции приведены в презентации к уроку
Слайды № 12, 13
(Учитель демонстрирует видео-фрагменты: «Взаимодействие брома с алюминием», «Взаимодействие хлора с железа с бромом», «Взаимодействие хлора с калием», «Вытеснение бромом иода»)
Применение галогенов. Слайд №14-17
Биологическое значение. Слайд №18
Получение галогенов. Слайд № 19
4 этап. Закрепление – 10 мин
Отгадайте кроссворд
↓ — По вертикали Вводное слово: Роль галогенов в окислительно-восстановительных реакциях
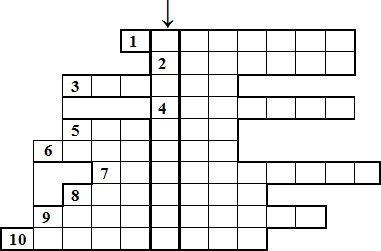
По горизонтали:
1.Явление перехода твердого вещества в газообразное, минуя жидкое, характерное для
кристаллического йода.
2.Органическое вещество, полисахарид, синеющее под действием свободного йода.
3.Заболевание зубов, часто вызываемое недостатком фтора.
4.Желудочная кислота, содержащая один из галогенов.
5.Огнеупорная пластмасса, содержащая фтор, применяемая для изготовления сковород и кастрюль.
6.Общее название соединений брома с металлами.
7.Важная железа эндокринной системы, содержащая йод.
8.Цвет газообразного хлора.
9.Вид ковалентной связи в молекулах галогенов.
10.Природный минерал состава KCl ∙ NaCl, применяемый как минеральное
Заключение. Слайд №20
5 этап. Рефлексия-3 мин
Учитель: Подведем итог урока.
Учитель задаёт вопросы:
Достигли ли мы цели урока?
Просит учащегося провести самооценку,
проанализировать ошибки и осуществить рефлексию урока смайликами.
6 этап. Домашнее задание – 2 мин
П.22,24, заполнить таблицу
|
Галоген |
Происхожде- ние названия |
История открытия |
Физические свойства |
Примене-ние |
Биологиче- ская роль: |
Образовательные.
Развивающие.
Воспитательные. Создавать условия для
формирования навыков устной и письменной речи с
применением средств ИКТ.
Оборудование: интерактивный комплекс,
презентации “Галогены”, “История открытия
галогенов”, раздаточный материал.
Тип урока: урок усвоения новых знаний
с элементами исследования.
Заполнение таблиц и решение примеров на
слайдах происходит по щелчку ЛКМ.
| Этапы урока | Деятельность учителя | Деятельность ученика | Контроль | |
| I | Организационный момент. | Приветствие учащихся, определение готовность к уроку. |
Приветствие учителя. | Фронтальный |
| II | Целеполагание, планирование деятельности |
Демонстрация слайда №2 презентации. | Фронтальное обсуждение, предлагают варианты ответов. (Возможные варианты ответов: химические вещества, применяются в быту, содержат атомы химических элементов). |
Фронтальный |
| Вопросы и задания.
Что объединяет эти Определите местоположение этих элементов в Обращает внимание, что эти элементы объединены |
Определяют местоположение элементов в ПСХЭ, приходят к выводу, что это элементы одной VII группы, главной подгруппы. Формулируют тему урока и записывают ее в |
Фронтальный, демонстрация слайда №3 (при наведении курсора на элементы галогены происходит их выделение). Демонстрация слайдов №4, №5. |
||
| III | Изучение нового материала.
1. Строение |
Демонстрация слайда №6 (левая часть таблицы). Задание: сравнить строение и свойства атомов галогенов. |
Находят сходство и различие в строении атомов, устанавливают причинно-следственные связи “состав – строение – свойства”, записывают в тетрадь общую формулу внешнего энергетического уровня атомов галогенов, характерные степени окисления. |
Заслушивание ответов, демонстрация слайда №6 (правая часть таблицы) |
| 2. История открытия галогенов.
Выступление |
Задание. Заполнить таблицу “История открытия галогенов” (Приложение 1. Раздается ученикам перед началом урока). |
Заслушивают сообщения и заполняют таблицу, указывая год открытия, автора, этимологию названия. |
Заслушивание сообщений, демонстрация слайда №7 (образец заполнения таблицы) |
|
| 3. Галогены – простые вещества.
Состав |
Демонстрация слайда №8.
Задание. |
Определяют вид химической связи, составляют электронную формулу молекулы галогенов. |
Демонстрация слайда №8 – образец ответа. |
|
| Физические свойства галогенов. | Демонстрация слайда №9.
Задание. Демонстрация видеоопыта “Возгонка йода” Демонстрация слайда №10. Историческая справка — флеш ролик “Использование Демонстрация слайда №11 (левая часть таблицы). |
Знакомятся с физическими свойствами галогенов, определяют, под каким номером находится каждый галоген, характеризуют его свойства, устанавливают причинно-следственные связи “строение – физические свойства”. Наблюдают опыт. Обсуждают, устанавливают Сравнивают свойства, вместе с учителем |
Заслушивание ответов.
Фронтальный. Фронтальный, демонстрация слайда №11 (правая |
|
| Химические свойства галогенов. | Задание. Познакомиться с химическими свойствами галогенов (стр. 106-108), выделить 4 группы свойств. Демонстрация видеопытов (слайды №12 – №1. “Взаимодействие калия с хлором”. №2. “Взаимодействие алюминия с бромом”. №3. “Взаимодействие водорода с хлором”, №4. “Взаимодействие фосфора с хлором”. №5. “Взаимодействие бромида и йодида калия с Задание. Объяснить, почему наиболее сильный |
Работают с текстом учебника, обсуждают в парах, выделяют 4 группы химических свойств. Наблюдают С помощью учителя на основе аналогии со |
Заслушивание ответов.
Самопроверка по образцу (слайды № 12-13). Фронтальный, заслушивание версий. |
|
| IV | Контроль и коррекция знаний по теме. | Задания (слайды 14-15) | Выполняют задания в тетрадях, сравнивают с образцом, исправляют ошибки. |
Самопроверка по образцу (слайды 14-15). Обсуждение результатов. |
| V | Подведение итогов урока. | Что узнали нового? Вызвало интерес?
Какие |
Обсуждают, высказывают свое мнение, составляют план следующего урока. |
Фронтальный. |
| VI | Домашнее задание. | Читать § 18, знать свойства галогенов, ответить на вопросы 2,3,4. Индивидуальные задания: подготовить сообщения “Биологическая роль галогенов”, “Применение галогенов”. |
Записывают задание в дневник. | Фронтальный. |
13.02.2017
Методическая разработка урока по теме «Галогены», 9 класс. Разработано в соответствии с требованиями ФГОС.
Оценить
942
Содержимое разработки
Тема урока : Галогены – простые вещества
Тип урока_:_ Урок изучения и первичного закрепления новых знаний и умений
Цели урока:
Личностные:создать условия для обучения умению работать в группах, продолжить формировать коммуникационную компетентность, развитие навыка адаптации к различным ролям при работе в группах, способствовать развитию умений оценивать свою работу на основе заданных критериев.
Метапредметные:развитие умений: вести диалог, слушать собеседника, задавать вопросы, необходимые для организации собственной деятельности и сотрудничества с партнером; определять цели и пути ее достижения; выделять и формулировать то, что усвоено, и то, что необходимо усвоить, определять функции участников совместной работы; развивать способности обучающихся: анализировать полученную информацию, обобщать, делать выводы.
Предметные: способствовать усвоению знаний о строении и физических свойствах галогенов; способствовать формированию представления о химических свойствах галогенов.
|
Этапы урока |
Основные дидактические задачи этапа |
Приёмы и виды заданий для активизации УУД различных блоков |
Примерное время |
|
1.Организационный |
Организационная. Объявление темы и плана урока |
Беседа с учащимися. Ответы на вопросы. |
2 минуты |
|
2. Этап подготовки к работе на основном этапе (актуализация знаний |
Обеспечение мотивации и формулирование цели урока. Актуализация опорных знаний и способов действий |
Формирование темы урока учащимися. Предлагается вспомнить умения давать характеристику элементам по положению в ПС Д.И.Менделеева; строение атомов и составление электронных формул элементов, выполнить задание |
5 минут |
|
3.Этап усвоения новых знаний и умений |
Обеспечение восприятия, осмысления и первичного запоминания изучаемого материала. Создание условий для усвоения методики воспроизведения изученного материала. |
Работа с инструктивными карточками, видео опыт, заполнение таблицы, работа с дополнительным материалом. |
25 минут |
|
4. Этап первичной проверки понимания изученного |
Взаимодействие учащихся с целью самостоятельно обобщить изучаемый материал |
Диалог учащихся о проделанной работе и об учебном материале, который они изучили. Выполнение тестовых заданий. Анализ и систематизация материала. |
9 минут |
|
5. Этап подведения итогов урока |
Обеспечить условия учащимся осмысленного формирования выводов. Оценка и самооценка работы класса и отдельных учащихся. |
Учащиеся самостоятельно формулируют выводы урока на основании проведенной работы и выполненных заданий по инструктивной карточке. |
3 минут |
|
6. Этап информации о домашнем задании |
Разъяснить понимание учащимися целей, содержания и способов выполнения д/з. |
1 минута |
Содержание приёмов и заданий , обуславливающих необходимость совершения УУД на различных этапах урока и описание методики их применения.
Организационный этап: Приветствие учащихся, оглашение темы урока.
2. Этап подготовки к работе на основном этапе (актуализация знаний)
Ребята мы изучаем раздел, неметаллы, и вы знаете, что неметаллы имеют большое значение в жизни современного человека. На предыдущем уроке мы изучили общие сведения о неметаллах: положение в периодической системе элементов Д.И.Менделеева, особенности строения их атомов. Сегодня приступаем к изучению наиболее ярких представителей в химическом отношении, самых активных неметаллов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках. Актуализация знаний. Беседа. Учитель: — На какие две большие группы происходит деление химических элементов? Ученик:- На металлы и неметаллы . Учитель: Что вы понимаете под неметаллом? Выберите и запишите только те определения, которые можно отнести к неметеллам.
•Малый радиус атома
•Малое количество электронов на внешнем энергетическом уровне
•Элементы чаще отдающие электроны
•Большое количество электронов на последнем энергетическом уровне
•Большой радиус атома
•Элементы чаще принимающие электроны
•Элементы с большим значением электроотрицательности
— Где находятся неметаллы в периодической системе Д.И. Менделеева. Ученик:- В периодической системе элементы – неметаллы расположены в правом верхнем углу периодической таблицы, условной границей, отделяющей металлы от неметаллов, служит диагональ, отведенная от бора к астату; 8 А подгруппа – инертные газы, 7 А подгруппа – галогены. Учитель:- Сегодня мы с вами будем вести разговор об элементах 7 А группы – галогенах .Учитель: Тема нашего урока “Галогены”.
Задачи нашего урока: Дать общую характеристику галогенам по их положения в периодической таблице. Рассмотреть их строение, сравнить физические и химические свойства. Узнать о важнейших соединениях галогенов. Определить области применения этих соединений. Каков наш план урока? Ученик: — Мы будем изучать положение галогенов в периодической системе; строение, физические и химические свойства и применение галогенов.
3.Этап усвоения новых знаний и умений
Учитель:
Постановка вопроса: Какие же свойства характерны для простых веществ – галогенов и чем они обусловлены?
Искать, сегодня, ответ на данный вопрос вы будете самостоятельно, разделившись на 5 групп. Каждая группа получит индивидуальную карточку с инструкцией к работе.
Учащимся предлагается разделиться на 5 групп. (Для каждой группы учащихся приготовлены инструктивные карточки для работы в группе.)
— Ребята, сейчас вы будете работать в своих группах и выполнять задания, содержащиеся в ваших инструкциях. По окончании этой работы, вы должны будете ознакомить с ней своих одноклассников, которые выполняли другие задания по данной теме.
Общая инструкция выполнения заданий для всех групп учащихся:
Внимательно прочитайте текст параграфа 32 и дополнительный текст.
Заполните таблицу.
Подготовьте устный ответ по своему заданию.
Подготовьте вопросы по теме своей карточки.
Учитель раздает инструктивные карточки с заданиями каждой группе:
Группа №1 (инструктивная карточка 1) : История открытия галогенов.
|
Галоген |
Происхождение названия |
Год открытия, ученый |
|
F |
||
|
Cl |
||
|
Br |
||
|
I |
Группа №2 (инструктивная карточка 2): Строение атомов галогенов.
|
Галоген |
Строение атома и его электронная формула |
Степени окисления |
|
F |
||
|
Cl |
||
|
Br |
||
|
I |
Группа №3 (инструктивная карточка 3): Изменение свойств галогенов с увеличением заряда ядра.
|
Галоген |
Агрегатное состояние (н.у.) |
Температура плавления, С |
Температура кипения, С |
Цвет |
Окислительная активность простых веществ |
Восстановительная активность простых веществ |
|
F |
||||||
|
Cl |
||||||
|
Br |
||||||
|
I |
Группа №4 (инструктивная карточка 4): Химические свойства галогенов ( на примере хлора).
|
Взаимодействие хлора с простыми веществами |
Взаимодействие хлора со сложными веществами |
Взаимодействие солей хлора с галогенами |
Группа №5 (инструктивная карточка 5): Влияние галогенов на организм.
|
Галоген |
Влияние на организм |
Первая помощь при отравлении |
|
F |
||
|
Cl |
||
|
Br |
||
|
I |
.
После изучения учебного материала каждой группой учащихся, им предлагается поменяться членами групп так, чтобы в новые группы попали учащиеся из разных групп. В новых группах ребята рассказывают друг другу о проделанной работе и о том учебном материале, который они изучили.
4.Этап первичной проверки понимания изученного
Учащиеся отвечают на вопросы и выполняют тестовые задания.
Тест:
К группе галогенов относят:
А) Si, Ca, Mg, Ba, In
Б) F, CL, Br, I, At
В) Cl, I, K, At, Na
Г) Cl, F, Ne, Xe, Cu
2. Строение внешнего энергетического уровня атомов галогенов отражает электронная формула:
А) 1s2 2s2
Б) 1s2 2s2 2p3
В) 1s2 2s2 2p5
Г) 1s2 2s2 2p4
3. Для галогенов характерны свойства:
А) окислительные
Б) восстановительные
В) окислительно-восстановительные
4. Активность атомов галогенов увеличивается в ряду:
А) F, Cl, Br, I, At
Б) Cl, Br, I, F, At
В) At, I, Br, Cl, F
Г) I, At, Cl, Br, F
5. Галогены взаимодействуют со всеми веществами группы:
А) H2O, H2, Na, O2
Б) HCl, NaCl, NaOH, K
В) Fe, O2, S, N2O5
Г) KOH, H2O, N2, HI
Этап подведения итогов урока
Учитель предлагает сформулировать общий вывод: Галогены – типичные неметаллы с очень высокой реакционной способностью, поэтому требуют осторожного обращения с ними.
Теперь проверяем правильность выполнения заданий составленных группами и тестовое задание.
Выставление оценок.
6. Этап информации о домашнем задании (с комментариями)
§32, упр. 4,5, стр. 161.
Задание по выбору: Применение галогенов.
Уебник : П.А.Оржековский, Л.М.Мещерякова, Л.С.Понтак, Химия 9 класс, Астрель Москва, 2012.
Дополнительный материал для урока:
История открытия галогенов:
О существовании фтора догадывались многие химики конца ХУШ – начала Х1Х вв., но получить его в чистом виде из-за его высокой активности не удавалось. В истории фтора много трагических страниц: многие ученые, которые изучали соединения фтора, теряли здоровье, гибли, так как соединения фтора очень ядовиты. Первооткрывателем свободного фтора стал французский химик А. Муассан. Он подверг электролизу охлажденный до -23 С безводный фтороводород, но выделяющийся бледно-желтый газ разрушил платино-иридиевый анод. Чтобы эксперимент был удачным, его нужно было проводить в присутствии гидродифторида калия. Спустя 20 лет за это открытие Муассан был удостоен Нобелевской премии по химии. Электролиз до сих пор остается единственным способом получения фтора.
Свойства элементарного хлора впервые были описаны в 1774 г. шведским химиком К.Шееле, который получил хлор при взаимодействии соляной кислоты с пиролюзитом MnO2. Шееле не считал этот желто-зеленый газ с характерным запахом самостоятельным химическим элементом. Только в 1810 г. Х. Дэви сделал правильный вывод: этот газ – простое вещество, образованное элементом, который Дэви назвал хлорином. Через год Гей-Люссак дал этому газу название – хлор.
Бром был открыт французским химиком А. Баларом. Он исследовал жидкость, полученную при растворении в воде золы морских водорослей. Обработав ее хлорной водой, Балар заметил, что р-р стал красно-бурым. Парижская академия наук рекомендовала назвать новый элемент бромом из-за неприятного запаха паров этого вещества ( в переводе с греческого «бром» значит «зловонный»).
Иод был открыт в 1811 г. французским химиком-технологом Б. Куртуа. Куртуа получил «новое вещество…в виде черного порошка, превращающегося при нагревании в пары великолепного фиолетового цвета». Название новому элементу дал известный химик Гей-Люссак. «Иодэйдес» в переводе с древнегреческого означает «фиолетовый» — по цвету паров этого вещества.
Влияние галогенов на организм человека
Соединения фтора вызывают сильные отравления. При отравлением фтористым натрием наблюдается рвота, иногда с кровью, понос, сильное возбуждение, снижение тонуса мышц, судороги, паралич дыхательного центра.
Первая помощь: промывание желудка, солевое слабительное. Обратиться к врачу!
Хлор – очень ядовитое вещество. Вдыхание паров хлора вызывает ожог слизистых оболочек дыхательных путей, кашель, удушье, боли в груди и в глазах, слезотечение, отек легких, ослабление работы сердца.
Первая помощь: вдыхание кислорода, теплых водяных паров с небольшой примесью нашатырного спирта. Полный покой, постельный режим. При попадании паров хлора в глаза нужно промыть их 2%-ным раствором соды и обратиться к врачу.
Бром ядовит. При вдыхании паров брома наблюдается насморк, кашель, удушье, явления бронхита и бронхопневмонии, слезотечение, конъюктивит. Слизистая рта и языка приобретают коричневый цвет. При приеме брома внутрь – боли в животе, рвота, понос.
Первая помощь: вдыхание паров воды с небольшой примесью нашатырного спирта, ингаляции с содовым раствором. При отравлении через рот необходимо промывание желудка 0,5%-ным тиосульфата натрия.
Иод ядовит. Симптомы острого отравления: бурое окрашивание языка и слизистой оболочки рта, рвота, понос, головная боль, насморк, кожная сыпь, в тяжелых случаях – судороги, коматозное состояние.
Первая помощь: промывание желудка 0,5%-ным раствором тиосульфата натрия, внутрь 20-30 г активированного угля в водной взвеси. Промывать и прополаскивать нос, рот и глотку 2%-ным раствором карбоната натрия.
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/244729-scenarij-uroka-po-temegalogeny-9-klass

«Свидетельство участника экспертной комиссии»
Оставляйте комментарии к работам коллег и получите документ
БЕСПЛАТНО!
1
План—конспект урока по теме: «Галогены».
Цель: сформировать знания у учащихся о галогенах, их свойствах,
применении, нахождении в природе, способах получения. Обратить
внимание на окислительные свойства этих веществ.
Задачи:
образовательные: в ходе изучения сформировать представления учащихся о
галогенах, при этом дать общую характеристику элементов (положение в
периодической системе), осветить вопрос об истории открытия этих веществ,
охарактеризовать нахождение галогенов в природе в виде соединений.
Познакомить учащихся со строением атома и видом химической связи в
молекулах галогенов. Обеспечить усвоение материала о получении хлора.
Изучить физические и химические свойства галогенов. Рассмотреть вопрос
о применении галогенов, при этом показать обусловленность применения
веществ их свойствами;
воспитывающие: воспитывать у учащихся внимательность на уроке,
продолжить формирование экологического мировоззрения, сформировать
умения устанавливать причинно—следственные связи, показать учащимся
взаимосвязь строения и свойств этих веществ.
развивающие: продолжить формирование взаимозависимых причинно—
следственных связей между составом веществ и их свойствами, свойствами
веществ и их применением, нахождением в природе; показать связь науки с
практикой. Сформировать умения учащихся сравнивать свойства веществ на
примере изучения свойств галогенов: делать предположение о зависимости
химических свойств от строения, выявлять существенные признаки в
изучаемом материале и на их основе проводить обобщение, анализировать
наблюдаемые опыты, делать выводы, определять типы химических реакций
на основе атомно—молекулярного учения.
Методы урока:
Словесный − объяснение нового материала.
Наглядный − демонстрация химического эксперимента с использованием
средств мультимедиа, применение демонстрационного эксперимента.
Оборудование: компьютер, мультимедийный проектор, CD—диск с
презентацией.
Наглядные пособия: периодическая система химических элементов Д.И.
Менделеева.
КОНСПЕКТ УРОКА по химии в 9м классе на тему:
«ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВ»
Подготовил учитель химии МБОУ СОШ №1 Выскребенцева С.В.
Цель урока: Дать общую характеристику галогенов и рассмотреть их физические и
химические свойства.
Задачи урока: 1) Продолжить формирование умений сравнивать свойства простых
веществ;
2) Закрепить общие представления о неметаллах и их свойствах;
3) Развивать умения и навыки в решении задач и составлении уравнений
Химических реакций с участием неметаллов.
Тип урока: урок усвоения новых знаний
Методы урока: беседа, рассказ, самостоятельная работа
Оборудование: Периодическая система химических элементов Д.И. Менделеева,
мультимедийная система, компьютер.
ХОД УРОКА:
1. Организационный момент. (12 мин)
Приветствие друг друга, настрой на работу, сообщение темы и целей сегодняшнего урока.
2. Проверка домашнего задания. (1012 мин)
1) Вызвать 3 человека к доске: 1 решает цепочку по середине доски,2е за досками
решают задачи:
Цепочка превращений:
→ HCl
Н2
NaOH
→ NaH
→
Н2
1) H2 + 2Na = 2NaH
2) NaH + HCl = NaCl + H2↑
3) H2 + Cl2 = 2HCl
4) NaH + H2O = NaOH + H2↑
5) 2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] +3H2 ↑
Задача №2 с.93
Дано: Решение:
V( возд.)=100 л V(O2)= V( возд.)* ᵠ (O2)= 100*0,21=
ᵠ (O2)=21% 21 л.
ᵠ (N2) =78% n (O2)= V/ Vm = 21л / 22,4 л/моль = 0,94 моль
n (O2)=? V(N2) = 100*0,78 = 78 л
n (N2) =? n (N2)=78л / 22,4л/моль = 3,48моль
Ответ: 0,94 моль, 3,48 моль.
Задача №3 с.103
Дано: Решение:
mтех.(WO3) =928 кг W(WO3) = 100%25%=75%
W(примес.) = 25% m (WO3) = mтех. * W (WO3) =
V(H2)=? 928кг * 0,75 = 696 кг
n(W)=? n(WO3)=m/M=696кг/232кг/кмоль = 3 кмоль
WO3 + 3Н2 = W + 3Н2О
1 моль 3моль 1моль
3 кмоль 9 кмоль 3 кмоль
V(H2)= nVm = 9 кмоль * 22,4 м3/кмоль = 201,6 м3 Ответ: 201,6 м3, 3 кмоль.
2) Все остальные пишут тест: выбрать номера свойств и характеристик для (1
вариант) металлов, для (2 вариант) неметаллов:
1) Маленький радиус атомов
2) Большой радиус атомов
3) На внешнем уровне от 1 до 3 электронов
4) На внешнем уровне от 4 до 8 электронов
5) Ковкость
6) Металлический блеск
7) Газообразное агрегатное состояние

9) Различная окраска
10) Плохая электропроводность
11) Твердое агрегатное состояние
12) Хорошая теплопроводность
13) Хорошая электропроводность
14) Ярко выраженные восстановительные свойства
15) Ярко выраженные окислительные свойства
16) Аллотропия
Правильные ответы: 1вариант – 2,3,5,6,8,11,12,13,14
2 вариант – 1,4,7,9,10,11,15,16
3. Изучение нового материала. (20 мин)
1. Положение в ПСХЭ и строение их атомов.
Галогены F, Cl, Br, I, At – элементы 7 группы главной подгруппы Периодической системы
хим. элементов.
на внешнем уровне 7 электронов;
увеличивается радиус атомов;
ослабевают неметаллические свойства;
окислительная
способность
уменьшается.
O
O
O
O
Фтор – самый сильный
окислитель (с.о.1)
У остальных: с.о. 1, +1, +3, +5,
+7
П
Помимо фтора, хлора, брома и
йода в этой группе есть еще
один элемент, относящийся к галогенам – это астат. Он был предсказан самим Д.И.
Менделеевым как экайод, он является радиоактивным элементом, поэтому в школьном
курсе не изучается.
2. Галогены простые вещества и нахождение их в природе.
Заслушивание сообщений о фторе, хлоре броме и йоде. (4 человека, ориентируясь на
слайды презентации, рассказывают о галогенах, истории их открытия, о соединениях, в
которых они встречаются в природе)
Остальной класс кратко конспектируют за
докладчиками. 3. Химические свойства галогенов.
1. Взаимодействие с простыми веществами:
а) с водородом Н2
Н2 + Г2 = 2НГ
Фтор взаимодействует с водородом в любых условиях со взрывом, хлор – со взрывом только
при поджигании или облучении прямым солнечным светом, бром реагирует с водородом
только при нагревании и без взрыва. Эти реакции экзотермические, реакция же йода с
водородом слабо эндотермическая, она протекает медленно даже при нагревании.
б) с металлами – образуются соли – галогениды металлов.
Так фтор уже при обычных условиях реагирует с большинством металлов, а при нагревании
реагирует даже с Au, Ag и Pt, известными своей химической пассивностью.
Остальные галогены реагируют с металлами в основном при нагревании. Так, в колбе,
наполненной хлором, красиво вспыхивают и сгорают кристаллики измельченной сурьмы:
2Sb + 3Cl2 = 2SbCl3 (просмотр видеофрагмента опыта сурьмы с хлором)
2Sb + 5Cl2 = 2SbCl5
Самостоятельное задание – написать уравнения реакций вздя железа с хлором, меди с
бромом.
2. Взаимодействие со сложными веществами:
а) с водой
2F2 + 2H2O = 4HF + O2
б) с галогенидами металлов (искл. составляет фтор, который в первую очередь
взаимодействует с водой)
Cl2
окислительная способность уменьшается от хлора к йоду:
Cl2 + 2NaBr = 2NaCl + Br2
Br2 + 2KI = 2KBr + I2
→ Br2
→ I2
4. Закрепление. (5мин.)
Ответить на 5 тестовых вопросов по изученной теме (см.слайды презентации)
5. Анализ оценок за урок. (1мин.)
Оценить отвечавших у доски д/з, выступавших с сообщениями о галогенах.
6. Домашнее задание: (1мин.)
Параграф 18, задания после него №4,5
Параграф 20, задание после него №1
Урок в 9 классе по теме «Галогены» (УМК О.С. Габриелян)
Автор: Пасевич Анжелика Анатольевна
Учитель химии и биологии МБОУ «СОШ п. Эгвекинот»
Первая квалификационная категория.
Галогены.
PPTX / 179.39 Кб
Тип урока: изучение нового материала, комбинированный.
Методы урока: объяснительно – иллюстративный, проблемно – поисковые, словесно – наглядные.
Средства обучения: мультимедийный комплекс
Контроль результатов обучения: индивидуальный, групповой; компьютерный контроль с использованием мультимедиа
Оборудование: ПК, медиапроектор, интерактивная доска, презентация «Галогены», Периодическая система химических элементов Д.И.Менделеева
Цели урока:
1.образовательные:
способствовать формированию знаний о строении атомов, физических и химических свойствах галогенов как типичных неметаллов. Изучить историю открытия галогенов. Формировать познавательные УУД: извлекать информацию и перерабатывать ее для получения необходимого результата.
2. развивающие:
продолжить развитие элементов информационной компетентности обучающихся, проявляющейся в умении получения и обработки информации из различных, в том числе компьютерных, информационных источников для решения учебных задач. Развитие критического мышления, способности к рефлексии; продолжить развитие умений выбора собственной траектории обучения, принятия на себя ответственности за получаемое образование; умения анализировать
3.воспитательные:
создавать условия для формирования навыков устной и письменной речи с применением средств ИКТ, воспитание культуры поведения, общения и культуры умственного труда
4. общеучебные:
а) учебно – организационные: составлять таблицы, схемы
б) учебно – интеллектуальные: умения сравнивать, анализировать.
Задачи:
На основании знания периодического закона, основных закономерностей изменения свойств элементов, простых веществ в Периодической системе химических элементов Д. И. Менделеева, теории строения вещества продолжить формирование понимания зависимости между строением, свойствами и применением на примере галогенов.
Продолжить формирование таких понятий, как ковалентная связь, электроотрицательность, степень окисления, химический элемент, окислительно – восстановительные реакции.
способствовать развитию умения мыслить логически и владеть химическим языком; переходу от формального – логического восприятия материала данной темы к образно-логическому мышлению с использованием разноуровневых, посильных и нестандартных задач.
развить навыки наблюдения, выявления ошибок, решения задач, умения выделять главное, сравнивать изучаемые факты, логично излагать мысли и делать выводы; учить размышлять, делать предположения, прогнозировать
содействовать формированию основных мировоззренческих идей через познавательную активность и творческую самостоятельность учащихся.
воспитывать умения работать самостоятельно с применением само- и взаимоконтроля. Показать связь изучаемой темы с жизнью. Воспитывать научное мировоззрение на основе взаимосвязи свойств и строения.
Приёмы активизации мыслительной деятельности учащихся:
1. Анализ учебной информации
2. Раскрытие межпредметных связей между химией, биологией, географией.
3. Выдвижение гипотез
4. Анализ и составление обобщающих таблиц.
Ожидаемые результаты обучения:
В результате изучения данной темы учащиеся:
· Получают знания о строении, свойствах и значении соединений галогенов на Земле. Получают представление о распространенности соединений галогеноводородов в природе
· Умеют использовать средства Microsoft Word, , Microsoft Power Point, Microsoft Office для подготовки презентаций, рефератов, докладов, проектных работ по данной теме.
Структура урока
Организационный момент
Ориентировочно – мотивационный момент
Изучение нового материала
Закрепление материала (тестирование)
Рефлексия
Домашнее задание.
Ход урока
Организационный момент
Цель этапа: создание положительных эмоций и проверка готовности обучающихся к уроку
Ориентировочно – мотивационный момент
Определение темы урока:
Обучающие отгадывают слова, которые записываются на интерактивной доске. При этом выделяются первые буквы другим цветом.
ГАЗООБРАЗНОЕ агрегатное состояние хлора?
АСТАТ элемент №85
ЛЕГКИЙ водород – это самый …. газ
ОКИСЛИТЕЛЬ фтор – это самый сильный …
ГОРЕНИЕ реакции соединения с кислородом с выделением тепла и света?
ЕВРОПИЙ элемент, названный в честь части света
НЕМЕТАЛЛЫ к какой группе относят элементы 4 – 8 группы
Дети называют тему урока.
Опираясь на алгоритм изучения элементов, определяют цели урока:
-положение галогенов в ПСХЭ Д.И.Менделеева;
— история открытия галогенов;
— строение, физические и химические свойства галогенов.
Вводная беседа, создание проблемной ситуации.
— какой галоген медикам служит и с крахмалом дружит? (хлор)
— какой галоген бактерии убивает и нам помогает? (йод)
— что общего в строении атомов галогенов и в чем отличия? (число электронов и число энергетических слоев)
— как опытным путем доказать, что химическая активность галогенов разная?
— чем объяснить окислительные способности галогенов, и какой галоген проявляет их в большей степени?
Чтоб ответить на вопросы обратимся к ПСХЭ Д.И.Менделеева
Изучение нового материала
Определить положение галогенов в ПСХЭ Д.И.Менделеева. Перечислить химические элементы – галогены и дать им краткую характеристику по алгоритму:
Порядковый номер, заряд ядра, количество электронов, протонов, нейтронов, количество электронов на внешнем слое, количество энергетических уровней, сравнить радиус ядра в группе сверху вниз, электроотрицательность, неметаллические свойства и окислительные свойства.
История открытия. Галогены – «Солеобразующие»
Заполнить таблицу «История открытия галогенов»
|
Название элемента |
Ученный, год открытия |
Этимология названия |
|
Фтор |
1886, Анри Муассан |
разрушающий |
|
Хлор |
1774, Карл Шееле |
Желто — зеленый |
|
Бром |
1826, Антуан – Жером Балар |
зловонный |
|
Йод |
1811, Бернар Куртуа |
фиолетовый |
|
Астат |
1940, Д.Корсон, К. Маккензи, Э. Сегре |
неустойчивый |
На основе схем строения атомов галогенов объясните изменение свойств галогенов в группе.
Определите вид связи в галогенах. Рассмотрим ее на примере хлора. Сколько неспаренных электронов содержит атом хлора, сколько общих электронных пар содержит молекула хлора? Определите тип кристаллической решетки.
Физические свойства. Сравнить физические свойства фтора, хлора, брома, астата. Демонстрация опыта «Возгонка йода»
Химические свойства.
Химическая активность галогенов, как неметаллов. От фтора до астата ослабевает. Каждый галоген является самым сильным окислителем в своем периоде. Окислительные свойства галогенов отчетливо проявляются при взаимодействии с металлами.
Демонстрация опыта «Горение сурьмы в хлоре».
Запишем уравнения реакции.
2Sb +3Cl2 = 2SbCl3,
2Sb + 5Cl2 = 2SbCl5.
Демонстрация опыта «Горение железа в хлоре»
Напишите (самостоятельно) уравнения реакций взаимодействия железа с хлором, алюминия с бромом и йодом. Рассмотрите их с точки зрения ОВР.
Закрепление материала (тестирование)
1В твердом состоянии кристаллические решетки галогенов
1) Молекулярные 2) Ионные
3) Металлические 4) Атомные
2Силы межмолекулярного взаимодействия максимальны между молекулами
1)F2 2) I2
3)Cl2 4) Br2
3При обычных условиях является жидким
1)Бром 2)Хлор
3) Йод 4) Фтор
4Не идет реакция в растворе
1) Br2 + Cl2 =
2) NaBr + Cl2 =
3) Cl2 + NaI =
4)KI + Br2 =
5 В реакции раскаленных железных опилок с хлором образуется
1)FeCl 2) FeCl2
3) FeCl3 4) FeCl4
6Активно реагирует с водой
1)Йод 2) Хлор
3)Бром 4) Фтор
7 Избыток хлора пропустили через 500 г 8,27%-го раствора йодида натрия. Определите массу образовавшегося йода
1) 38г
2) 35 г
3) 32 г
4) 29 г
8 Полностью прореагировали 50 л. Водорода (н.у) и 75 л (н.у.) хлора. Определите объемную долю хлора (н.у.) в полученной смеси газов
-
-
2,20
0,25
0,33
0,5
-
9 Распределите нижеперечисленные галогены в порядке повышения их температур плавления и кипения:
Хлор
Йод
Фтор
Бром Ответ дайте в виде последовательности цифр
10 Распределите ниже перечисленные галогены в порядке увеличения их окислительных свойств
Фтор
Хлор
Йод
Бром . Ответ дайте в виде последовательности цифр.
Правильные ответы: 1, 2, 1, 1, 3, 4, 2, 1, 3142, 3421.
Взаимопроверка:
10-9 – «5»
8-7 – «4»
6-5 – «3»
Менее 5 – «2»
Рефлексия
Нарисуем смайлик в тетради после записей на уроке.
Все понятно. Понял, но с затруднением Ничего не понял


Домашнее задание. П.18 упр.4- 7 на стр. 110
Источники
http://открытыйурок.рф/%D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/630525/
https://nsportal.ru/shkola/khimiya/library/2012/04/19/plan-konspekt-uroka-khimii-v-9-m-klasse-s-ispolzovaniem-tsor-po
Тест по химии: 9 кл.: М.А.Рябов. – М.: Издательство «Экзамен», 2016.
Уроки химии с применением ИКТ. Неметаллы. 9 класс. Методическое пособие с электронным приложением/Т.М.Солдатов.- М.: Планета, 2011. (Современная школа).
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
УМК «Химия. 9 класс» О. С. Габриеляна.
Цели урока: обобщение знаний по теме «галогены и их соединения». Развитие интереса к предмету. Учить выступать, формулировать свои мысли , анализировать, Находить причинно-следственные связи, делать выводы. Приобретать навыки работы в команде. Показать практическую направленность изучения химии, ответственность науки, людей перед природой и жизнью.
Тип урока: Комбинированный.
Форма работы: Ролевая игра «Международная конференция по теме «Галогены»».
Оборудование: Компьютер, презентация по теме, таблички на столах с названием стран (Россия, Германия, Франция, США) и изображением флага этих государств, бейджики у участников игры.
Межпредметные связи: история, биология, экология.
Действующие лица:
- Ученый секретарь (ведущий)
- Представители делегаций:
- России
- Германии
- Франции
- США
- Историк
- Эксперт
- Эколог
Вступительное слово учителя: Одной из задач химии является создание веществ с заранее заданными свойствами. Ежегодно создаются сотни новых веществ с теми свойствами, которые необходимы для их применения. Но ,к сожалению, многие синтезированные вещества несут в себе как бы двойственную функцию. Вместе с улучшением жизни и деятельности человека, подчас наносится непоправимый вред. И не только окружающей нас среде, но и самому человеку. Об этом говорить можно много и приводить массу примеров, но мы сегодня затронем лишь маленькую частичку этой огромной проблемы.
Вы имеете честь присутствовать на Международной конференции, а чему она посвящена, вы сейчас узнаете.
Слово ученому секретарю. Мы собрались обсудить проблему галогенов, все их положительные и отрицательные качества. Разрешите напомнить Вам с чем мы имеем дело. Галогены, то есть рождающие соли, занимают главную подгруппу 7 группы Периодической таблицы химических элементов. Их объединяет сходное строение внешнего уровня, на котором находится по 7 электронов. Их высшая валентность равна 7. Формула высшего оксида Э2О7. Все они очень сильные окислители, так как до завершения внешнего уровня не хватает 1 электрона. Характерная степень окисления –1, но в соединениях с кислородом /кроме фтора/ проявляют положительные степени окисления: +1, +3, +5, +7. Но и среди галогенов имеются различия, обусловленные зарядом их ядер. Так с увеличением заряда ядра, увеличивается радиус атома, уменьшаются неметаллические свойства и окислительные способности. Наше обсуждение мы начнем снизу периодической таблицы, с элемента под № 53.
Слово предоставляется представителю делегации Франции. Основной источник йода на земле-Мировой океан, куда этот важнейший микроэлемент поступает из атмосферы. Йод участвует в образовании гормонов щитовидной железы, регулирующих обмен веществ, в частности энергетические процессы и теплообмен. Важен для нормального функционирования сердечно- сосудистой и центральной нервной систем. Э то важнейший элемент, без которого наш организм существовать не может. «Мы так мало о нем знаем, и так плохо понимаем основные вехи в истории его странствий, что до сих пор является непонятным, почему мы лечим при помощи йода» — писал академик Ферсман. Йод был выделен как самостоятельное вещество французским химиком Б. Куртуа при селитровании в 1811 году. Изучение его продолжил Гей-Люссак, который и дал ему название по цвету паров («иодес» по-гречески- фиолетовый). Со второй половины 19 века йод стал широко применяться в медицине, которая до сих пор остается главным его потребителем. В 60-е годы Пирогов ввел в хирургическую практику спиртовую настойку йода для лечения ран. В настоящее время препараты йода применяются как ренгеноконтрастное вещество. Единственный понятный факт в биографии йода-применения его при заболеваниях щитовидной железы. Йод содержат все ткани, но половина его количества приходится на щитовидную железу, нарушение функции которой вызывает глубокие расстройства физиологического состояния организма. Впервые прямую зависимость заболеваний от содержания йода в воде, почве, продуктах питания обнаружил в 1854 году французский химик Шатен. С тех пор йододефицитные состояния относят к числу самых распространенных болезней. Эндемический зоб, рак щитовидной железы, низкий рост, задержка умственного развития у детей и умственная заторможенность у взрослых. Недостаток йода во время беременности может стать причиной появления на свет глухонемых детей.
О том, как можно восполнить йододефицит расскажет член делегации России. Распространенность йододефицитных заболеваний в нашей стране велика, так как в связи с особенностями геохимического состава почвы более 60% территории России находится в зоне йододефицита. Какими способами можно предупредить последствия недостаточности йода в окружающей среде? Прежде всего, употребление в пищу морской рыбы и морепродуктов, богатых йодом. Во всем мире наиболее эффективным способом является йодирование продуктов питания, и главным образом соли. 5-6 грамм такой соли полностью обеспечит йодом организм взрослого человека. Также сейчас в некоторые хлебобулочные изделия добавляют йод.
Ученый секретарь: Следующий элемент, о котором мы узнаем — бром. Элемент под номером 35.
Слово предоставляется представителю делегации Германии. 30 ноября 1825 года молодой французский химик Антуан Балар послал в Парижскую академию наук сообщение об особом веществе, содержащимся в морской воде. Открытый им элемент Балар назвал мурилом. Приехавшая комиссия подтвердила открытие, но рекомендовала изменить название вещества, назвав его бромом, положив в основу одно из его свойств как у хлора и йода. По-гречески бром означает «зловонный». Бром относится к рассеянным элементам. Как примесь он входит в состав сотен минералов , но свои почти не образует. Есть бром и в атмосфере. ПОДСЧИТАНО, ЧТО ВМЕСТЕ С МОРСКОЙ ВОДОЙ В ВОЗДУХ ПЕРЕХОДИТ ОКОЛО 4 МЛН Т.БРОМА. Море – главный поставщик брома. Довольно много его в организмах морских рыб. Он всегда присутствует и в организмах земных животных, не исключая и человека. Потребность в броме у разных организмов отличается. В организме человека бром обнаружен в крови, почках, печени и больше всего в мозге.
Ученый секретарь: Как же используется бром? Послушаем. Применять растворы бромистого натрия и калия стали лет через 10 после его открытия, как средство от бессонницы, переутомления. Особенно полезны, по мнению врачей, бромистые препараты при нарушении соотношения процессов возбуждения и торможения в головном мозге. Поэтому наш мозг и накапливает бром. Бромистое серебро- главная соль химико-фотографической промышленности. Много профессий и у бромистого лития. Он предотвращает коррозию в холодильных установках, помогает кондиционировать воздух. А текстильщики широко применяют органический краситель броминдиго, позволяющий получать широкую гамму всевозможных оттенков. Также броморганическими соединениями пропитывают древесину для устойчивости к атмосферным воздействиям и грибкам. Бромхлорметан — отличный огнетушитель, который к тому же не проводит электрический ток, поэтому им удобно тушить загоревшуюся проводку. И вот для получения этих крайне полезных веществ нужен ядовитый, зловонный, агрессивный, крайне неприятный в общении, но тем не менее незаменимый бром. Данными о каком-то особом вредном влиянии брома на окружающую среду мы не располагаем.
Ученый секретарь: Не менее интересна история элемента под номером 9.
Слово предоставляется нашему коллеге из делегации США. Фтору свойственны все особенности собратьев по подгруппе, однако он похож на человека без чувства меры: все увеличено до крайности, до предела. Это объясняется, прежде всего, его положением в периодической системе. Его место- «полюс неметаллических свойств»- правый верхний угол. Он обладает необычайной реакционной способностью и образует соединения почти со всеми элементами. Совсем недавно, в 50-х годах, большинство химиков считало, и на то были основания, что благородные газы не могут образовывать истинные химические соединения. Однако вскоре три из шести элементов-«затворников» не смогли устоять перед натиском агрессивного фтора. И начиная с 1962 г. Получены их фториды.
Атомы фтора обладают очень большой электроотрицательностью. Горячая вода сгорает в струе фтора с выделением кислорода. Но не только вода, но и другие обычно не горючие материалы, такие как асбест, кирпич, многие меиаллы загораются в струе фтора. Бром, йод, сера, селен, фосфор, мышьяк, кремний, древесный уголь, самовоспламеняются во фторе при обычной температуре, а при небольшом нагревании та же участь постигает и благородные металлы, известные своей химической пассивностью. Поэтому неудивительно название фтора. В переводе с греческого это слово означает «разрушающий».
Сегодня мы также знаем, что фтор очень токсичен, что работа с ним и его соединения требует большой осторожности и продуманных мер защиты.
Первооткрыватели фтора могли об этом только догадываться, да и то не всегда. Поэтому история его открытия связана с именами многих героев науки.
Английские химики братья Томас и Георг Нокс пытались получить фтор из фторидов серебра и свинца. Опыты окончились трагически. Георг стал инвалидом, Томас погиб. Та же участь постигла Никлеса и Лайета.
Выдающийся химик 19 века Хэмфри Дэви, создатель водородной теории кислот, человек, впервые получивший натрий, калий, магний, кальций, стронций, барий, доказавший элементарность хлора, не смог решить проблемы получения всеразрушающего элемента. В ходе опытов он отравился и тяжело заболел.
Гей-Люссак и Тенар потеряли здоровье. Более удачливыми оказались Ферми, Лавуазье и Фарадей. Их фтор «пощадил», но и они не добились успеха.
26 июня 1886г. Французский химик Анри Муасан при электролизе фторида водород получил несколько пузырьков газа. Это был фтор! Соединения фтора находят широчайшее применения: стекольное пищевая, нефтяная, атомная, металлургическая, химическая, авиационная, бумажная, фармацевтическая промышленность — вот далеко не полный перечень тех отраслей где они используются.
Ученый секретарь: где же используют соединения фтора?
Член делегации США: В своей хозяйственной деятельности человечество часто использует насыщенные газообразные или жидкие фторуглероды (соединения фтора и углерода), часто содержащие атомы хлора и брома.- Так называемые ФРЕОНЫ или ХЛАДОНЫ. Наиболее часто встречающие. Все эти вещества в природе естественным путём не образуется за исключением фреона- II, небольшое количество которого обнаружено в газовых выбросах вулканов на Курильских островах, и, следовательно, появления их в атмосфере обусловлено антропогенным фактором. Фреоны обладают уникальным набором свойств, которые обеспечили им широкое применение в промышленности. Эти вещества имеют низкие температуры кипения, не ядовиты, не горючи, взрывобезопасны , химически инертны. Они не действуют на конструкционные материалы, а в малых доз безвредны для людей. При высоких концентрациях некоторые обладают наркотическим действием (Фреон l 2) а иногда удушающим (Фреон l 42, 22). Интенсивное использование фреонов началось в 50-е годы. Фреоны являются распространенными хладогенами в холодильниках и кондиционерах, используются как носители активных пропелленов в аэрозольных баллончиках, получивших широкое распространение в быту. В такой удобной для дозировки упаковке выпускают множество продуктов: лекарств, краски, косметические средства моющие препараты, инсектициды. При получении пенопластов фреоны используют для формирования полостей и пузырьков. Ряд фреонов применяют как компоненты огнетушащих составов в системах автоматического пожаротушения (фреон II 3 ВI). Некоторые фреоны незаменимые растворители. К 1975 г. Мировое производство фреонов достигло 800 тыс. в год.
Ученый секретарь: С какими – же сложностями мы столкнулись?
Слово представителю Германии. Трудно было предложить, что эти, казалось бы безвредные, соединения могут представить серьёзную угрозу для биосферы в целом. Однако оказалось , что фреоны , будучи химическими инертными соединениями при попадании в тропосферу ее разрушаются в ней. Ученые установили, что время удаления фреонов из океанов, обусловленное гидролизом (т.е. разложением водой) или микробиологическим разрушение составляет: (для фреонов II — 70 лет, фреонов I2 – 200 лет). Действие почвенных микроорганизмов также незначительно так как время удаления фреонов из почвы под их воздействием составляет 10 тыс. лет. Это означает, что попавшие в тропосферу фреоны медленно диффундируют в атмосферу. Сами по себе фреоны не представляют опасности для озонового экрана, так как эти вещества инертны по отношению к озону. Однако специальные наблюдения с помощью воздушных шаров показали, что фреоны на расстоянии 20 км подвергаются фотохимическому распаду, выделяя хром, бром. Атомы хлора действуют как сильные катализаторы распада озона. В разрушении фреона, кроме ультрафиолетового излучения участвует и атомарный кислород.
Ученый секретарь: Что же делается в связи с этой проблемой?
Осознание этой опасности побудило ряд государств значительно сократить или вовсе прекратить выпуск и применение фреонов. Так, в качестве репеллентов стали использовать газ пропан, который хотя и горюч, но дешевле фреонов и не опасен по своим отдаленным последствиям. Для холодильников предложены менее летучие фторхлорпроизводные соединения, например фреон13, вместо фреона12. Таким образом, уже делаются конкретные шаги для сохранения озонового слоя планеты.
Ученый секретарь: Самую большую проблему вызывают соединения элемента с порядковым номером 17.
Представители Росси проделали огромную работу, заслушаем их отчет.
На западе Фландрии лежит крошечный городок. Тем не менее, его название известно всему миру и долго еще будет сохраняться в памяти человечества как символ одного из величайших преступлений против человечества. Этот городок- Ипр. Креси – Ипр – Хиросима – вехи на пути превращения войны в гигантскую машину уничтожения. В начале 1915 года на линии западного фронта образовался так называемый Ипрский выступ. Союзные англо-французские войска к северо-востоку от Ипра вклинились на территорию, занятую германской армией. Германское командование решило нанести контрудар и выровнять линию фронта. Утром 22 апреля, когда дул ровный норд-ост, немцы начали необычную подготовку к наступлению – они провели первую в истории войн газовую атаку. На Ипрском участке фронта были одновременно открыты 6000 баллонов хлора. В течение пяти минут образовалось огромное, весом в 180 т, ядовитое желто-зеленое облако, которое медленно двигалось по направлению к окопам противника. Этого никто не ожидал. Войска французов и англичан готовились к атаке, к артиллерийскому обстрелу, солдаты надежно окопались, но перед губительным хлорным облаком они были абсолютно безоружными. Смертоносный газ проникал во все щели, во все укрытия. Результаты первой химической атаки (и первого нарушения Гаагской конвенции 1907 г. о неприменении отравляющих веществ!) были ошеломляющими – хлор поразил около 15 тысяч человек, причем примерно 5 тысяч – на смерть. И все это – ради того, чтобы выровнять линию фронта длиной в 6 км! Спустя два месяца немцы приняли хлорную атаку и на восточном фронте. А через два года Ипр приумножил свою печальную известность. Во время тяжелого сражения 12 июля 1917 г. в районе этого города было впервые применено отравляющее вещество, названное впоследствии ипритом. Иприт – это производное хлора, дихлордиэтисульфид .Об этих эпизодах истории, связанных с одним маленьким городком и одним химическим элементом, мы напомнили это для того, чтобы показать, как опасен может быть элемент №17 в руках воинствующих безумцев. Это – самая мрачная страница истории хлора. Но было бы совершенно неверное видеть в хлоре только отравляющее вещество и сырье для производства других отравляющих веществ.
Ученый секретарь: слово имеют историки: История элементарного хлора сравнительного коротка, она ведет начало с 1774 года. История соединений хлора стара, как мир. Достаточно вспомнить, что хлористый натрий – это поваренная соль. И, видимо, в доисторические времена была подмечена способность соли консервировать мясо и рыбу. Самые древние археологические находки – свидетельства использования соли человеком относится примерно к 3-4 тысячелетию до н.э. А самое древнее описание добычи каменной соли встречается в сочинениях греческого историка Геродота (5 в. до н.э.). Геродот описывает добычу каменной соли в Ливии. В оазисе Синах в центре Ливийской пустыни находился знаменитый храм Бога Амона-Ра. Поэтому Ливия и именовалась «Ammonia», и первое название каменной соли было «sal ammoniacum». Позднее, начиная примерно с 13-го века н.э., это название закрепилось за хлористым аммонием. В «Естественной истории» Плиния Старшего описан метод отделения золота от неблагородных металлов при прокаливании солью и глиной. А одно из первых описаний очистки хлористого натрия находим в трудах великого арабского врача и алхимика Джабир ибн – Хайяна (в европейском написании – Гебер).Весьма вероятно, что алхимики сталкивались и с элементарным хлором, т.к. в странах Востока уже в 9-м веке, а в Европе в 13-м веке была известна «царская водка» – соляной и азотной кислот. В выпущенной в 1668 г. книги голландца Ван–Гельмонта «Hortus Mediciane» говорится, что при совместном нагревании хлористого аммония.
Ученый секретарь: слово представителю США. В наше время все многообразие практического применения хлора можно без особой натяжки выразить одной фразой: хлор необходим для получения хлорпродуктов, то есть веществ, содержащих связанный хлор. А вот говоря о хлорпродуктах, одной фразой не отделаешься. Они все очень разные и по свойствам и по назначении. Химикаты в окружающей среде-большая проблема. Вся сложность состоит в том, что роль химических продуктов двойственна. С одной стороны, новые вещества облегчают и улучшают нашу жизнь. Другая сторона дела состоит в том , что многие продукты химии крайне ядовиты, а потому опасны для здоровья и окружающей среды.Посмотрим двойственность новых веществ на примере пестицидов. В 1998 г. американская академия наук опубликовала доклад, в котором говорится, что в предстоящие 70 лет более 1 миллиона американцев рискуют заболеть раком, вызванным наличием 28 канцерогенных пестицидов в пище.
Ученый секретарь: основным докладчиком выступает глава делегации России. В России проблема последствий необдуманного применения пестицидов тоже одна из самых острых (Черноземы, буквально нафаршированы пестицидами). Пестициды – (от лат. Зараза, убиваю) – общее название химических препаратов для борьбы:
- с сорняками (гербициды); с насекомыми (инсектициды)
- с грибковыми заболеваниями (фунгициды) сельскохозяйственных растений, деревьев, кустарников, зерна и др.
Пестициды помогают увеличить урожай, облегчают хранение и перевозку продукции сельского хозяйства. Таким образом, пестициды, попадая в больших количествах в окружающую среду, ухудшают качество воды, пищи, воздуха, почвы, (изменяют их естественный качественный и количественный состав), а также наносят огромный вред экосистемам или их частям. О том, что химикаты, попавшие в хозяйственный оборот (а также вещества, выбрасываемые в природу в виде отходов производства) могут представлять собой значительную опасность для человека и его среды, стало известно сравнительно недавно. Опасные свойства некоторых веществ распознавались лишь после их длительного применения.«Показательным» в этом отношении является пестицид ДДТ, содержащий хлор (хлорированный углеводород).
Ученый секретарь: Слово нашему эксперту. Это вещество впервые было синтезировано и предложено в качестве средства борьбы с вредителями сельского хозяйство в 1940 году швейцарским химиком Паулем Мюллером, удостоенным за эту работу Нобелевской премии. Казалось, что применение этого вещества позволит человечеству справиться со многими проблемами – благодаря применению ДДТ. Резко уменьшился ущерб, наносимый саранчой и другими вредителями – насекомыми. Миллионы людей были спасены от малярии, разносимой комарами. Однако вскоре изумление перед мощью ДДТ изменило радужную окраску на трагическую. Это средство в 60-х годах очень широко использовалось против самых разных насекомых, как в сельском хозяйстве, так и в быту (против мух, комаров, клопов, блох, вшей). Вначале были видны только положительные результаты его применения. Но! Постепенно была выявлена крайняя опасность ДДТ для большинства животных и человека. Оказалось, что молекулы ДДТ быстро включились в природные процессы миграции и круговорота веществ. Атмосферными потоками ДДТ было разнесено на большое расстояние. Благодаря этому ДДТ распространился по всей биосфере, его обнаружили даже в птичьих яйцах в Антарктиде. В 1971 году применение ДДТ было запрещено в СССР.Каков механизм действия ДДТ на организм? — ДДТ легко растворяется в жировых веществах, содержащихся в клетках животных и растений. Поэтому этот яд накапливается внутри организма. Положение усугубляется высокой стабильностью молекул данного вещества, способностью циркулировать в биосфере более 50 лет, не теряя при этом своих свойств. Попадая в организмы, яд развивает в них необратимые изменения, приводящие постепенно к гибели. Например Сейчас идет падение численности тюленей на побережьях Северного моря и морских птиц в Ирландском море. Гибель тюленей и птиц связывают с накоплением ДДТ в их организмах. Так в 1 кг жира тюленей у бритаских берегов содержится 10-40 мг ДДТ. Трагедия постепенной гибели от ДДТ ожидает и пеликанов. Если в пеликаньих яйцах содержится хотя бы 4 мг/кг на ДДТ, их скорлупа заметно утоньшается. Такие яйца часто раздавливаются насиживающей их самкой пеликана. Калифорнийский пеликаны, в яйцах которых среднее содержание ДДТ до 71мг/кг, уже с 1969 года не могут размножаться и вымирают. Та же судьба ожидает морских птиц и в других районах, если концентрация ДДТ в морской воде, а значит, и в рыбе, которой питаются птицы, хотя бы ненамного повысится.
Выделено десять основных загрязнителей атмосферы:
- Сернистый газ – (SO2) – содержится в дымах промышленных предприятий. Вызывает респираторные заболевания, наносит вред растениям.
- Углекислый газ – (CO2) – образуется при сгорании всех видов топлива. Повышает температуру атмосферы.
- Окись углерода – (CO) – образуется при неполном сгорании топлива. Может нарушить тепловой баланс верхней атмосферы.
- Оксиды азота – создают смог и вызывают респираторные заболевания и бронхит. Способствуют чрезмерному разрастанию водной растительности.
- Фосфаты – Содержатся в удобрениях. Главный загрязнитель вод в реках и озерах.
- Ртуть – опасный загрязнитель пищевых продуктов, особенно морского происхождения. Вредно действует на нервную систему человека.
- Свинец – добавляется в бензин. Действует на ферментные системы и обмен веществ в живых клетках.
- Нефть – приводит к пагубным экологическим последствиям, вызывает гибель планктонных организмов, рыбы, морских птиц и млекопитающих.
- ДДТ и другие пестициды – очень токсичны для ракообразных, убивают рыбу и организмы, служащие кормом для рыб. Многие являются канцерогенами.
- Радиация – в превышено допустимых дозах приводит к злокачественным новообразованиям и генетическим мутациям.
Вы видите, что пестициды относятся к наиболее опасным загрязнителям. Поэтому так важно уменьшить их вредное влияние. Что же конкретно принимается для решения данной экологической проблемы? Ученый секретарь: Небольшое дополнение есть у представителя американской делегации.
Во-первых, совершенствуются формы и методы их применения.
Во-вторых, меняется (улучшается) ассортимент пестицидов (пестициды первого поколения были, в основном, соединениями мышьяка и ртути и сильно загрязняли окружающую среду, сейчас выпускают менее опасные пестициды 3 и 4 поколения).
В-третьих, сокращено применение препаратов, содержащих мышьяк и ртуть; не разрешается применение в растениеводстве препаратов ДДТ; ограничено применение препаратов гептахлора, гексахлорана, полихлорпирена, севина.
Ученый секретарь: слово главному экологу. До недавнего времени пестициды на больших площадях применяли в форме порошков, распыляемых, как правило, с самолетов. Сейчас переходят к гранулированным препаратам и к ультрамалому опрыскиванию. Что это дает? -При опрыскивании жидкими препаратами резко сокращается (по сравнению с опылением) снос препаратов и снижается загрязнение воздуха. Метод опрыскивания в настоящее время составляет более 90% общего количества обработок пестицидами. Кроме этого, в последние годы наблюдается отказ от сплошных авиаобработок и переход на выборочные, локальные, производимые наземной аппаратурой. И важно знать, что одно из самых эффективных средств борьбы с вредителями и болезнями растений – севообороты.
Учитель: А теперь перед перед участниками нашей конференции ставятся экологические задачи. Свои решения сдадите ученому секретарю для подведения итогов.
Задачи для участников конференции
1 группа
1. Какое химическое явление лежит в основе пожаров? Каковы вероятные действия: а/химика, б/физика при тушении пожара? Нужны ли пожарному знания по химии и физике? Для чего?
2. При сжигании в карбюраторе автомобиля 1 кг горючего в воздух выбрасывается до 800 г оксида углерода(II). Рассчитайте массу оксида углерода образующегося при сжигании 100 тонн жидкого топлива.
2 группа
1. К каким последствиям приведет слив жидкого топлива (бензина, керосина, мазута) в закрытый водоем? Почему?
2. Предложите новый метод хранения яблок. Перед укладкой на зимнее хранение их погружают на несколько секунд в раствор хлорида кальция. Вычислите массовую долю соли в растворе, если на приготовление его расходуется 800 г воды и 1,5 г хлорида кальция.
3 группа
1. Добавка 10 г водорода на каждые 90 г бензина более чем в 100 раз снижает токсичность выхлопных газов сельскохозяйственной техники. Скажется ли это новшество на продуктивности животных и урожайности сельскохозяйственных культур? Почему?
2. Одинаковые ли объемы хлора можно получить для сельскохозяйственных нужд ( обеззараживание почв, сохранение продукции на складах) исходя из а/ 10 кг хлорида натрия, б/ 10 кг хлорида калия?
4 группа
1. Заболевший ящуром рогатый скот поят холодной водой с добавлением соляной кислоты. Вычислите объемы водорода и хлора, необходимые для приготовления 10 г 8,3 % раствора кислоты (на 1 ведро).
2. Колодезную воду называют чистой. Какую очистку она прошла в толще земли? Можно ли ее назвать дистиллированной? Почему?
5 группа
1. В результате реакции соединения водорода с хлором образуется хлороводород, водный раствор которого – соляная кислота – используется для орошении трав при силосовании. Определите объем хлороводорода, полученного при расходе хлора количеством вещества 5 моль.
2. Крупный животноводческий комплекс загрязняет окружающие водоемы не менее, чем промышленные предприятия. Как можно очистить животноводческие стоки?
Для зрителей
Рассчитайте массовую долю йода в йодиде калия. Сколько грамм йода можно получить из 1 моля йодида калия?
Литература
- Задания по химии для учащихся малокомплектной школы. Р.Н.Князева, В.П.Артемьев. Москва «Просвещение»,1993г.
- Популярная библиотека химических элементов. Наука. Москва.1977г.
- Экология и химия. Г.П.Никифорова. А.Ю. Жегин. Институт общего образования министерства образования Российской Федерации.1992 г.
Используемые презентации
- http://prezentacii.com/po_himii/2322-brom.html
- http://prezentacii.com/biologiya/7374-iod-i-ego-rol-v-zhivom-organizme.html
- http://prezentacii.com/po_himii/3697-hlor-fiziologicheskaya-i-patologicheskaya-rol-v-organizme-cheloveka.html

